上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
关联产品
实验工具|稀释计算器|摩尔浓度计算器

上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
关联产品

实验工具|稀释计算器|摩尔浓度计算器
上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
特点:
● POD标记的产品可以在大约3个小时内制备。
● 可以标记高分子量化合物(MW> 50,000)和低分子量化合物(MW <5,000)。
● 可以标记50至200μg的蛋白质。
● POD标记的产品只需与NH2-反应性过氧化物酶混合即可形成。
● 可以通过使用过滤管的分离操作以高回收率获得标记物质。
● POD标签可以用随附的保存溶液保存。


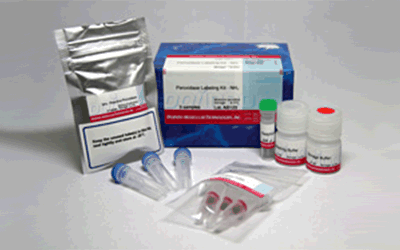
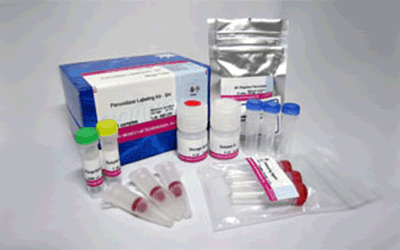
试剂盒内含

产品概述
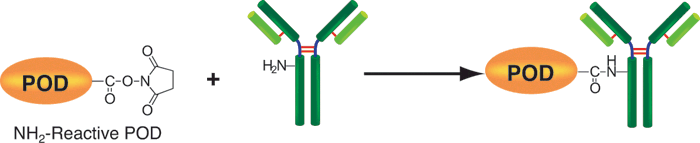
该试剂盒主要用于制备酶免疫分析 (EIA) 所需的辣根过氧化物酶标IgG以及竞争性EIA所需的辣根过氧化物酶标抗原。该试剂盒中的NH2-reactive peroxidase具有琥珀酰亚胺基 (NHS),它能够与含有NH2的蛋白质或者其他分子反应。该试剂盒包含了标记过程中所需的所有试剂,包括储存用缓冲液。标记过程相当简单:只需将IgG和NH2-reactive peroxidase混合并且在37℃下培养2小时。NH2-reactive peroxidase不需任何活化就可以和靶分子形成共价键。NHS与辣根过氧化物酶之间的距离大约为1.2nm,为辣根过氧化物酶分子半径的一半。因此,当辣根过氧化物酶标IgG用于EIA时,NH2-reactive peroxidase的高效性足以使它在标记后省去纯化的过程。即使在标记后需要有一个高纯度的精制过程,也只要用亲和柱或凝胶渗透柱就能简单达到目的。在标记小分子的时候,使用试剂盒中包含的过滤管即可除去分子量较大的分子。由于NH2-reactive peroxidase自身的氨基已经被阻断,因此自身不会发生反应。
原理
操作步骤
使用注意事项:
1.所需标记的较大的蛋白质的分子量要>50,000。
2.所需标记的较小的氨基化合物的分子量要<5,000。
3.标记过程中,标记前后的IgG总是在过滤管的滤膜上。
4.如果IgG溶液含有其它分子量超过10,000的蛋白质,如BSA或凝胶,在使用该试剂盒标记前请先纯化IgG溶液。IgG溶液能够使用IgG纯化试剂盒来纯化(不包含于此试剂盒中)。如果IgG溶液中含有小的不溶物,离心后提取上清液来标记。
5.如果长时间不使用,建议您把试剂盒中的酶NH2-reactive peroxidase放在-20℃冰箱中保存,不需要充氮气,可以更好地保持酶的活性,但请不要把其它试剂和过滤管放到-20℃冰箱中,仍请放在0-5℃冰箱中保存。
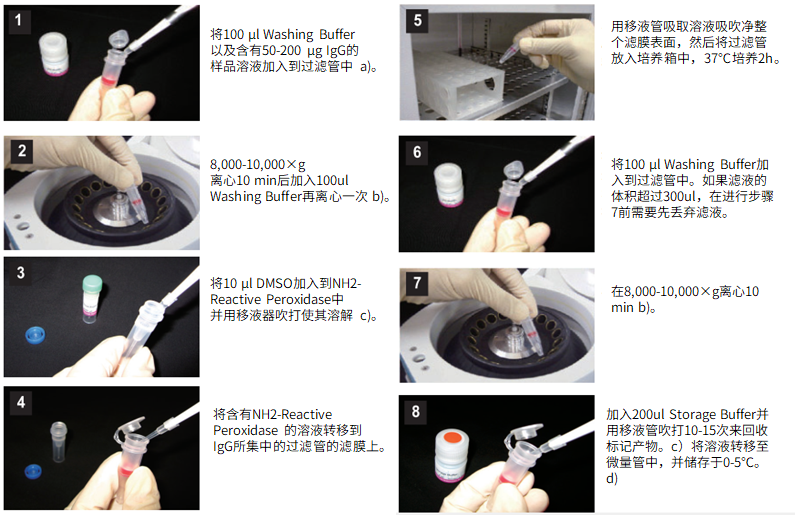
标记IgG操作步骤:
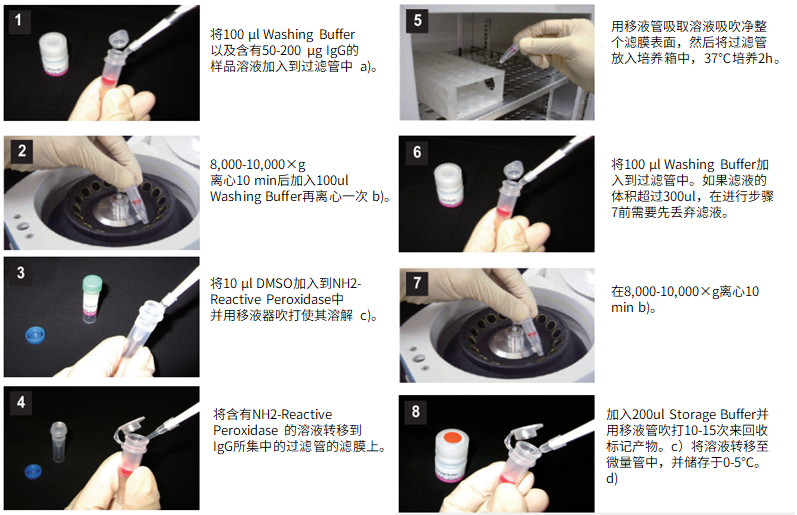
(1)将100μl Washing buffer以及含有50-200μg IgG的样品溶液加入到过滤管中。a)
(2)8,000-10,000g离心10分钟后,加入100μl Washing buffer再离心一次。b)
(3)将10μl Reaction buffer加入到NH2-reactive peroxidase中并用移液器吹打使其溶解。
(4)将含有NH2-reactive peroxidase的溶液转移到IgG所集中的过滤管的滤膜上。
(5)用移液器吸取溶液吹吸净整个滤膜表面,然后将过滤管放入培养箱中,37℃培养2小时。
(6)将100μl Washing buffer加入到过滤管中。如果滤液的体积超过300μl,在进行步骤7前需要先丢弃滤液。
(7)8,000-10,000g离心10分钟。b)
(8)加入200μl Storage buffer并用移液器吹打10到15次来回收标记产物。c)将溶液转移至0.5ml的试管中,并储存于0-5℃下。d)
a)推荐的IgG的量为100μg,样品溶液的体积不应超过100μl。如果抗体浓度低于0.5mg/ml,重复步骤1和2直至总的IgG聚积量达到50-200μg。如果在聚积过程中,滤液体积达到或超过了400μl,则需在进行下一步离心前将滤液除去。
b)如果溶液在离心后仍然残留在膜上,可以再离心5分钟或者适当增加转速。
c)标记产物的浓度为0.5-1.3mg/ml。在进行后续的酶免疫,免疫印迹,免疫转染试验前先要将标记后的IgG稀释至适当的浓度。每个IgG分子上会被标记上1-3个辣根过氧化物酶分子。没有被结合的辣根过氧化物酶不会干扰正常的免疫试验。如果一定要纯化的话,可以使用凝胶渗透柱或亲合柱。
d)通常,辣根过氧化物酶标记后的IgG在Storage buffer中,0-5℃下至少能够保存2个月,如果需要保存更久,可以添加等量的丙三醇(终浓度:50%),并在-20℃下存放。但是,还要注意样品自身是否稳定。
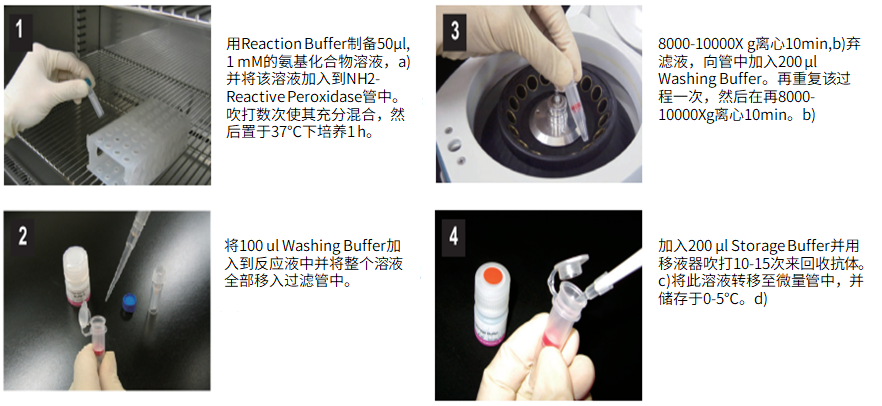
标记小分子操作步骤:
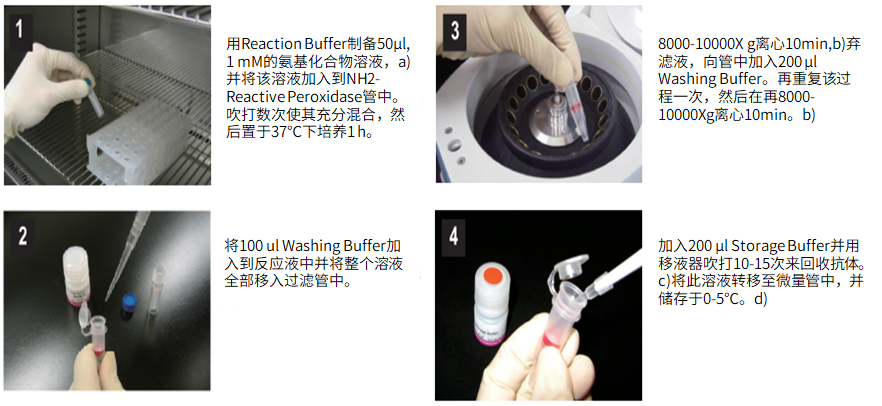
(1)用Reaction buffer制备50μl,1mM的氨基化合物,a)并将该溶液加入到NH2-reactive peroxidase管中。吹打数次使其充分混合,然后置于37℃下培养1小时。
(2)将100μl Washing buffer加入到反应液中并将整个溶液全部移入过滤管中。
(3)在8,000-10,000g 离心10分钟,b)弃滤液,向管中加入200μl Washing buffer。再重复该过程一次,然后再在8,000-10,000g 离心10分钟。b)
(4)加入200μl Storage buffer并用移液器吹打10到15次来回收抗体。c)将溶液转移至0.5ml的试管中,并储存于0-5℃下。d)
a)如果氨基化合物在水溶液中无法溶解,可以用DMSO使其溶解,制备成10mM的溶液,取5μl 与45μl Reaction buffer混合。
b)如果溶液在离心后仍然残留在膜上,可以再离心5分钟或者适当增加转速。
c)标记产物的浓度大约为400-500μg/ml (10-12.5μM)。1-2个靶分子能够和1个辣根过氧化物酶分子结合。
d)标记后的小分子在0-5℃下能够存放至少6个月。
产品优势
1)POD标记的产品可以在大约3个小时内制备。
2)可以标记高分子量化合物(MW> 50,000)和低分子量化合物(MW <5,000)。
3)可以标记50至200μg的蛋白质。
4)POD标记的产品只需与NH2-反应性过氧化物酶混合即可形成。
5)可以通过使用过滤管的分离操作以高回收率获得标记物质。
6)POD标签可以用随附的保存溶液保存。
常见问题Q&A
| Q1: 标记反应结束后,未反应的NH2-reactive peroxdase是否还具有活性? |
| A:没有了。它在反应过程中会完全被水解。 |
| Q2: 标记反应过程中,NH2-reactive peroxdase是否会形成一些低聚物? |
| A:不会。由于NH2-reactive peroxdase中的所有氨基都被阻断,因此不会有低聚物生成。 |
| Q3: 是否必须要使用试剂盒所包含的Storage Buffer? |
| A:不一定要使用试剂盒所包含的Storage Buffer。可以选择任何适用于该实验的缓冲液。但是,Storage Buffer能够提高标记产物的稳定性。 |
| Q4:Storage Buffer中是否含有动物产品或者高分子聚合物? |
| A:Storage Buffer中不含有任何动物产品,高分子聚合物或者重金属离子。 |
| Q5: 能够使用这个试剂盒标记Fab或者Fab’吗? |
| A:可以标记。并且回收率通常都超过80%。 |
| Q6:能够用这个试剂盒标记其它蛋白质吗? |
| A:可以。只要标记分子的分子量>50,000或者<5,000且具有活性伯胺或仲胺结构。如果分子量>50,000,参照IgG的标记操作说明,使用0.5-1 nmol蛋白样品用LK11-10来标记。 如果分子量<5,000,参照标记小分子的操作说明。如果分子量>5,000且<50,000,请咨询我们的客户服务。Email:info@dojindo.cn 免费电话:800-988-0083 |
| Q7:能够使用这个试剂盒标记寡核苷酸或者寡肽吗? |
| A:可以。只要它的分子量小于5,000且具有活性伯胺或仲胺。可以参照标记小分子的操作说明。 |
| Q8:LK11所能标记的最小的IgG的量是多少? |
| A:最小量为50 μg。标记50 μg与200 μg之间的IgG,在灵敏度和本底上没有太大的区别。尽管这个试剂盒也能标记10 μg的IgG,但是本底会较高。 |
| Q9:每个IgG能够标记多少辣根过氧化物酶分子? |
| A:每个IgG平均能标记上1-3个辣根过氧化物酶分子。 |
参考文献
1) 広田次郎, 清水眞也, “キットを用いたモノクローナル抗体への迅速・簡便なペルオキシダーゼ標識法”, 動物衛生研究所研究報告, 2005, 111, 37.
2) A. Miyagawa-Yamaguchi, N. Kotani, and K. Honke, “Expressed Glycosylphosphatidylinositol-Anchored Horseradish Peroxidase Identifies Co-Clustering Molecules in Individual Lipid Raft Domains”, PLoS ONE., 2014, 9, (3), e93054.
3) J. Zhang, D. Klufas, K. Manalo, K. Adjepong, J.O. Davidson, G. Wassink, L. Bennet, A.J. Gunn, E.G. Stopa, K. Liu, M. Nishibori, and B.S. Stonestreet, “HMGB1 Translocation After Ischemia in the Ovine Fetal Brain”, J. Neuropathol. Exp. Neurol.., 2016, 75, (6), 527.
4) M. Okumura, T. Ozawa, H. Hamana, Y. Norimatsu, R. Tsuda, E. Kobayashi, K. Shinoda, H. Taki, K. Tobe, J. Imura, E. Sugiyama, H. Kishi, and A. Muraguchi, “Autoantibodies reactive to PEP08 are clinically related with morbidity and severity of interstitial lung disease in connective tissue diseases”, Eur. J. Immunol.., 2018, 48, (10), 1717.
5) R. Sugisawa, G. Komatsu, E. Hiramoto, N. Takeda, K. Yamamura, S. Arai, and T. Miyazaki, “Independent modes of disease repair by AIM protein distinguished in AIM-felinized mice”, Sci. Rep.., 2018, 8, 13157.
6) S. Takatsuka, T. Inukai, S. Kawakubo, T. Umeyama, M. Abe, K. Ueno, Y. Hoshino, Y. Kinjo, Y. Miyazaki, and S. Yamagoe, “Identification of a Novel Variant Form of Aspergillus fumigatus CalC and Generation of Anti-CalC Monoclonal Antibodies”, Med Mycol J., 2019, 60, (1), 11.
7) T. Sasaki, K. Liu,T. Agari, T. Yasuhara, J. Morimoto, M. Okazaki, H. Takeuchi, A. Toyoshima, S. Sasada, A. Shinko, A. Kondo, M. Kameda, I. Miyazaki, M. Asanuma, CV. Borlongan, M. Nishibori, and I. Date, “Anti-high mobility group box 1 antibody exerts neuroprotection in a rat model of Parkinson’s disease”, Exp. Neurol.., 2016, 275, 220.
8) T. Tsumuraya, I. Fujii, M. Inoue, A. Tatami, K. Miyazaki, and M. Hirama, “Production of monoclonal antibodies for sandwich immunoassay detection of ciguatoxin 51-hydroxyCTX3C”, Toxicon., 2006, 48, (3), 287.
9) W. Jin, K. Yamada, M. Ikami, N. Kaji, M. Tokeshi, Y. Atsumi, M. Mizutani, A. Murai, A. Okamoto, T. Namikaw, Y. Baba, and M. Ohta, “Application of IgY to sandwich enzyme-linked immunosorbent assays, lateral flow devices, and immunopillar chips for detecting staphylococcal enterotoxins in milk and dairy products”, J. Microbiol. Methods., 2013, 92, (3), 323.
10) W.W.P.N. Weerakoon, M. Sakase, N. Kawate, M.A. Hannan, N. Kohama, and H. Tamada, “Plasma IGF-I, INSL3, testosterone, inhibin concentrations and scrotal circumferences surrounding puberty in Japanese Black beef bulls with normal and abnormal semen”, Theriogenology., 2018, 114, (1), 54.
11) Y. Watanabe, Y. Kazuki, K. Kazuki, M. Ebiki, M. Nakanishi, K. Nakamura, M. Yoshida Yamakawa,H. Hosokawa, T. Ohbayashi, M. Oshimura, and K. Nakashima, “Use of a Human Artificial Chromosome for Delivering Trophic Factors in a Rodent Model of Amyotrophic Lateral Sclerosis”, Mol Ther Nucleic Acids., 2015, 4, (10), e253.
12) Y.S. Kim, D.H. Jung, I.S. Lee, B.J. Pyun and J.S. Kim, “Osteomeles schwerinae extracts inhibits the binding to receptors of advanced glycation end products and TGF-β1 expression in mesangial cells under diabetic conditions”, Phytomedicine., 2016, 23, (4), 388.
13) S .Kon, M. Honda, K. Ishikawa, M. Maeda and T. Segawa, “Antibodies against nephronectin ameliorate anti-type II collagen-induced arthritis in mice.’, FEBS Open Bio., 2019,10.1002/2211-5463.12758.
上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
特点:
● POD标记的产品可以在大约3个小时内制备。
● 可以标记高分子量化合物(MW> 50,000)和低分子量化合物(MW <5,000)。
● 可以标记50至200μg的蛋白质。
● POD标记的产品只需与SH反应过氧化物酶混合即可形成。
● 还可以通过使用附着的还原剂标记不具有游离SH基团的蛋白质。
● 可以通过使用过滤管的分离操作以高回收率获得标记物质。
● POD标签可与随附的存储溶液一起存储。


试剂盒内含

产品概述
该试剂盒主要用于制备酶免疫分析(EIA)所需的辣根过氧化物酶标IgG以及竞争性EIA所需的辣根过氧化物酶标抗原。该试剂盒中的SH-reactive peroxidase能够与含有巯基的蛋白质或者其他分子反应。该试剂盒包含了标记过程中所需的全部试剂,包括还原剂和储存用缓冲液。SH-reactive peroxidase可以和靶分子形成共价键,还原剂能够在IgG分子上建立自由巯基。当辣根过氧化物酶标IgG用于EIA时,SH-reactive peroxidase的高效性足以使它在标记后省去纯化的过程。即使在标记后需要有一个高纯度的精制过程,也只要用亲和柱或凝胶渗透柱就能简单达到目的。在标记小分子的时候,使用试剂盒中包含的过滤管即可除去分子量较大的分子。
原理
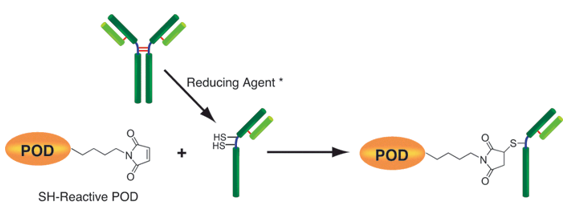
操作步骤
使用注意事项:
1.所需标记的较大的蛋白质的分子量要>50,000。
2.所需标记的较小的巯基化合物的分子量要<5,000。
3.标记过程中,标记前后的IgG总是在过滤管的滤膜上。
4.如果IgG溶液含有其它分子量超过10,000的蛋白质,如BSA或凝胶,在使用该试剂盒标记前请先纯化IgG溶液。IgG溶液能够使用IgG纯化试剂盒来纯化(不包含于此试剂盒中)。
5.如果IgG溶液中含有小的不溶物,离心后提取上清液来标记。
6.如果长时间不使用,建议您把试剂盒中的酶SH -reactive peroxidase放在-20℃冰箱中保存,不需要充氮气,可以更好地保持酶的活性,但请不要把其它试剂和过滤管放到-20℃冰箱中,仍请放在0-5℃冰箱中保存。
标记IgG操作步骤:
(1)将100μl Solution A以及含有50-200μg IgG的样品溶液加入到过滤管中。a)
(2)用移液器使溶液混合,8,000-10,000g离心10分钟。b)
(3)将150μl Solution A加入到Reducing agent中并用移液器吹打使其溶解。
(4)将100μl步骤3所得溶液转移到IgG所集中的过滤管的滤膜上。
(5)用移液器吹打数次,然后在37℃下培养30分钟。
(6)将100μl Solution B加入到过滤管中,8,000-10,000g离心10分钟。除去滤液,加入200μl Solution B,再离心一次。b)
(7)将50μl Reaction buffer加入到SH-reactive peroxidase中并用移液器吹打使其溶解。
(8)将SH-reactive peroxidase溶液移到被还原的IgG所集中的过滤管的滤膜上。
(9)用移液器吹打数次,然后在37℃下培养1小时。
(10)将100μl Solution A加入到试管中,8,000-10,000g离心10分钟。b)
(11)加入200μl Storage buffer并吹打10-15次来回收标记产物。c)将此溶液转移至一支0.5ml的试管,并储存于0-5℃。

a)推荐的IgG的量为100μg,样品溶液的体积不应超过100μl。如果抗体浓度低于0.5mg/ml,重复步骤1和2直至总的IgG聚积量达到50-200μg。如果在聚积过程中,滤液体积超过了400μl,则需在进行下一步离心前将滤液除去。
b)如果溶液在离心后仍然残留在膜上,可以再离心5分钟或者适当增加转速。
c)标记产物的浓度为0.5-1.3mg/ml。在进行后续的酶免疫,免疫印迹,免疫转染试验前先要将标记后的IgG稀释至适当的浓度。每个还原后的IgG分子上会被标记 上1到2个辣根过氧化物酶分子。没有被结合的辣根过氧化物酶不会干扰正常的免疫试验。如果一定要纯化的话,可以使用凝胶渗透柱或亲合柱。
d)通常辣根过氧化物酶标记后的还原型IgG在Storage buffer中,0-5℃下至少能够保存2个月,如果需要保存更久,可以添加等量的丙三醇(终浓度:50%),并在-20℃下存放。另外,还要注意样品自身是否稳定。
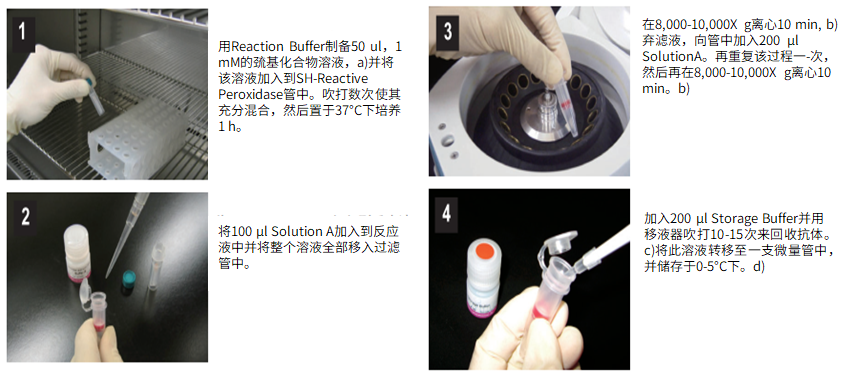
标记小分子操作步骤:
(1)用Reaction buffer制备50μl,1 mM的巯基化合物溶液,a)并将该溶液加入到SH-reactive peroxidase管中。吹打数次使其充分混合,然后置于37℃下培养1小时。
(2)将100μl Solution A加入到反应液中并将整个溶液全部移入过滤管中。
(3)在8,000-10,000g离心10分钟,b)弃滤液,向管中加入200μl Solution A。再重复该过程一次,然后再在8,000-10,000g离心10分钟。b)
(4)加入200μl Storage buffer并用移液器吹打10-15次来回收抗体。c)将此溶液转移至一支0.5ml的试管中,并储存于0-5℃下。d)
a)如果巯基化合物无法在水溶液中溶解,可以用DMSO使其溶解,制备成10mM的溶液,取5μl 与45μl Reaction buffer混合。
b)如果溶液在离心后仍然残留在膜上,可以再离心5分钟或者适当增加转速。
c)标记产物的浓度大约为400-500μg/ml(10-12.5μM)。1到2个靶分子能够和1个辣根过氧化物酶分子结合。
d)标记后的小分子在0-5℃下能够存放至少6个月。
产品优势
1)POD标记的产品可以在大约3个小时内制备。
2)可以标记高分子量化合物(MW> 50,000)和低分子量化合物(MW <5,000)。
3)可以标记50至200μg的蛋白质。
4)POD标记的产品只需与SH反应过氧化物酶混合即可形成。
5)还可以通过使用附着的还原剂标记不具有游离SH基团的蛋白质。
6)可以通过使用过滤管的分离操作以高回收率获得标记物质。
7)POD标签可与随附的存储溶液一起存储。
常见问题Q&A
| Q1: 能够使用这个试剂盒标记F(ab’)2吗? |
| A:可以标记。请参照标记IgG的操作说明,回收率通常都超过80%。 |
| Q2: 能够用这个试剂盒标记其他蛋白质或者多肽吗? |
| A:可以,只要标记分子的还原型分子量>50,000或者<5,000且具有活性巯基结构。如果分子量.>50,000,参照IgG的标记操作说明,使用0.5-1 nmol蛋白样品用 LK09-10来标记。如果分子量<5,000,参照标记小分子的操作说明。如果分子量>5,000且<50,000,请咨询我们的客户服务。Email:info@dojindo.cn 免费电话 :800-988-0083 |
| Q3: 能够使用这个试剂盒标记寡核苷酸或者寡肽吗? |
| A:可以,只要它的分子量小于5,000且具有活性巯基。可以参照标记小分子的操作说明。 |
| Q4:LK09所能标记的最小的IgG的量是多少? |
| A:最小量为50 μg。标记50 μg与200 μg之间的IgG,在灵敏度和本底上没有太大的区别。但是,在步骤8,使用SH-reactive peroxidase溶液时,用量缩小为原来的1/5,也能够标记10 μg的IgG。 |
| Q5: 每个IgG能够标记多少辣根过氧化物酶分子? |
| A:每个IgG平均能标记上1-2个辣根过氧化物酶分子。 |
| Q6:标记蛋白质之前是否必须先使用过滤管? |
| A:如果蛋白溶液中不含有带有活性巯基的小分子并且蛋白浓度在10 mg/ml或者70 μM左右,则没有必要使用过滤管。只需要将样品溶液和Solution B混合,再把混合液加入到SH-reactive peroxidase管中即可。 |
| Q7:是否必须要使用试剂盒所包含的Storage Buffer? |
| A:不一定要使用试剂盒所包含的Storage Buffer。可以选择任何适用于该试验的缓冲液。但是,Storage Buffer能够提高标记产物的稳定性。 |
| Q8:我的样品中含有小的不溶物,我该怎么办? |
| A:低速离心后用上清液来标记。 |
| Q9:标记反应结束后,未标记的SH-reactive peroxidase是否仍然含有活性马来酰亚胺? |
| A:不含有。几乎100%的SH-reactive peroxidase都被用于了IgG或者小分子的标记。 |
| Q10:Storage Buffer中是否含有动物产品或者高分子聚合物? |
| A:Storage Buffer中不含有任何动物产品,高分子聚合物或者重金属离子。 |
参考文献
| 1) 広田次郎, 清水眞也, “キットを用いたモノクローナル抗体への迅速・簡便なペルオキシダーゼ標識法”, 動物衛生研究所研究報告, 2005, 111, 37. |
| 2) K. Inoue, A. Sugiyama, P. C. Reid, Y. Ito, K. Miyauchi, S. Mukai, M. Sagara, K. Miyamoto, H. Satoh, I. Kohno, T. Kurata, H. Ota, A. Mantovani, T. Hamakubo, H. Daida and T. Kodama, “Establishment of a High Sensitivity Plasma Assay for Human Pentraxin3 as a Marker for Unstable Angina Pectoris”, Arterioscler. Thromb. Vasc. Biol., 2007, 27, 161. |
| 3) N. Esaki, Y. Ohkawa, N. Hashimoto, Y. Tsuda, Y. Ohmi, R. H. Bhuiyan, N. Kotani, K. Honke, A. Enomoto, M. Takahashi, K. Furukawa, and K. Furukawa, “ASC amino acid transporter 2, defined by enzyme-mediated activation of radical sources, enhances malignancy of GD2-positive small-cell lung cancer.”, Cancer Sci.., 2018, 109, (1), 141. |
| 4) G.W.Zhanga, S.J.Lai, Y.Yoshimura, and N.Isobe, “Messenger RNA expression and immunolocalization of psoriasin in the goat mammary gland and its milk concentration after an intramammary infusion of lipopolysaccharide”, Vet. J.., 2014, 202, (1), 89. |
| 5) G-W. Zhang, S-J. Lai, Y. Yoshimura, and N. Isobe, “Expression of cathelicidins mRNA in the goat mammary gland and effect of the intramammary infusion of lipopolysaccharide on milk cathelicidin-2 concentration”, Vet. Microbiol.., 2014, 170, (1-2), 125. |
| 6) H. Tateno, S. Saito, K. Hiemori, K. Kiyoi, K. Hasehira, M. Toyoda, Y. Onuma, Y. Ito, H. Akutsu, and J. Hirabayashi, “α2–6 sialylation is a marker of the differentiation potential of human mesenchymal stem cells”, Glycobiology., 2016, 26, (12), 1328. |
| 7) K. Iizumi, H. Kawasaki, A. Shigenaga, M. Tominaga, A. Otsu, A. Kamo, Y. Kamata, K. Takamori, and F. Yamakura, “Tryptophan nitration of immunoglobulin light chain as a new possible biomarker for atopic dermatitis”, J Clin Biochem Nutr., 2018, 63, (3), 197. |
| 8) K. Morioka, K. Fukai, K. Yoshida, R. Yamazoe, H. Onozato, S. Ohashi, T. Tsuda, and K. Sakamoto, “Foot-and-Mouth Disease Virus Antigen Detection Enzyme-Linked Immunosorbent Assay Using Multiserotype-Reactive Monoclonal Antibodies”, J. Clin. Microbiol.., 2009, 47, (11), 3663. |
| 9) M. Watanabe, I. Takemasa, N. Kaneko, Y. Yokoyama, E. Matsuo, S. Iwasa, M. Mori, N. Matsuura, M. Monden, and O. Nishimura, “Clinical significance of circulating galectins as colorectal cancer markers”, Oncol. Rep.., 2011, 25, (5), 1217. |
| 10) M. Yasunaga, S. Saijou, S. Hanaoka, T. Anzai, R. Tsumura, and Y. Matsumura, “Significant antitumor effect of an antibody against TMEM180, a new colorectal cancer‐specific molecule”, Cancer Sci.., 2019, 110, (2), 761. |
| 11) N. Esaki, Y. Ohkawa, N. Hashimoto, Y. Tsuda, Y. Ohmi, R. H. Bhuiyan, N. Kotani, K. Honke, A. Enomoto, M. Takahashi, K. Furukawa, and K. Furukawa, “ASC amino acid transporter 2, defined by enzyme‐mediated activation of radical sources, enhances malignancy of GD2‐positive small‐cell lung cancer”, Cancer Sci.., 2018, 109, (1), 141. |
| 12) N. Hashimoto, K. Hamamura, N. Kotani, K. Furukawa, K. Kaneko, K. Honke, and K. Furukawa, “Proteomic analysis of ganglioside‐associated membrane molecules: Substantial basis for molecular clustering”, Proteomics., 2012, 12, (21), 3154. |
| 13) N. Kotani, Y. Ida, T. Nakano, I. Sato, R. Kuwahara, A. Yamaguchi, M. Tomita, K. Honke, and T. Murakoshi, “Tumor-dependent secretion of close homolog of L1 results in elevation of its circulating level in mouse model for human lung tumor”, Biochem. Biophys. Res. Commun.., 2018, 501, (4), 982. |
| 14) R. Yamashita, N. Kotani, Y. Ishiura, S. Higashiyama, and K. Honke, “Spatiotemporally-regulated interaction between β1 integrin and ErbB4 that is involved in fibronectin-dependent cell migration”, J. Biol. Chem.., 2011, 149, (3), 347. |
| 15) T. Noro, E. Oishi, T. Kaneshige, K. Yaguchi, K. Amimoto, and M. Shimizu, “Identification and characterization of haemagglutinin epitopes of Avibacterium paragallinarum serovar C”, Vet. Microbiol.., 2008, 131, (3-4), 406. |
| 16) K. Okada, H. Itoh and M. Ikemotob, “Circulating S100A8/A9 is potentially a biomarker that could reflect the severity of experimental colitis in rats’, Heliyon, 2020, 6, (2), e03470. |
上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
特点:
● POD标记的产品可以在大约3个小时内制备。
● 可以标记高分子量化合物(MW> 50,000)和低分子量化合物(MW <5,000)。
● 可以标记50至200μg的蛋白质。
● POD标记的产品只需与NH2-反应性过氧化物酶混合即可形成。
● 可以通过使用过滤管的分离操作以高回收率获得标记物质。
● POD标签可以用随附的保存溶液保存。

活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Fluorescein Labeling Kit – NH2 荧光素标记试剂盒-氨基
NO.2. Cell Counting Kit-8 细胞增殖毒性检测
NO.3. Annexin V, FITC Apoptosis Detection Kit 细胞凋亡检测
NO.4. Cytotoxicity LDH Assay Kit-WST 乳酸脱氢酶(LDH)检测
NO.5. HiLyte Fluor 647 Labeling Kit – NH2 荧光素标记-氨基
试剂盒内含

产品概述
该试剂盒主要用于制备酶免疫分析 (EIA) 所需的辣根过氧化物酶标IgG以及竞争性EIA所需的辣根过氧化物酶标抗原。该试剂盒中的NH2-reactive peroxidase具有琥珀酰亚胺基 (NHS),它能够与含有NH2的蛋白质或者其他分子反应。该试剂盒包含了标记过程中所需的所有试剂,包括储存用缓冲液。标记过程相当简单:只需将IgG和NH2-reactive peroxidase混合并且在37℃下培养2小时。NH2-reactive peroxidase不需任何活化就可以和靶分子形成共价键。NHS与辣根过氧化物酶之间的距离大约为1.2nm,为辣根过氧化物酶分子半径的一半。因此,当辣根过氧化物酶标IgG用于EIA时,NH2-reactive peroxidase的高效性足以使它在标记后省去纯化的过程。即使在标记后需要有一个高纯度的精制过程,也只要用亲和柱或凝胶渗透柱就能简单达到目的。在标记小分子的时候,使用试剂盒中包含的过滤管即可除去分子量较大的分子。由于NH2-reactive peroxidase自身的氨基已经被阻断,因此自身不会发生反应。
原理
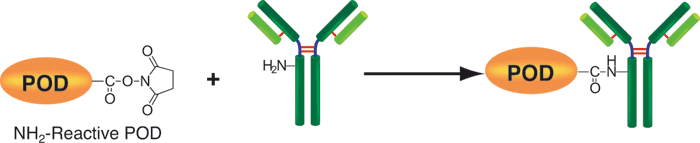
操作步骤
使用注意事项:
1.所需标记的较大的蛋白质的分子量要>50,000。
2.所需标记的较小的氨基化合物的分子量要<5,000。
3.标记过程中,标记前后的IgG总是在过滤管的滤膜上。
4.如果IgG溶液含有其它分子量超过10,000的蛋白质,如BSA或凝胶,在使用该试剂盒标记前请先纯化IgG溶液。IgG溶液能够使用IgG纯化试剂盒来纯化(不包含于此试剂盒中)。如果IgG溶液中含有小的不溶物,离心后提取上清液来标记。
5.如果长时间不使用,建议您把试剂盒中的酶NH2-reactive peroxidase放在-20℃冰箱中保存,不需要充氮气,可以更好地保持酶的活性,但请不要把其它试剂和过滤管放到-20℃冰箱中,仍请放在0-5℃冰箱中保存。
标记IgG操作步骤:
(1)将100μl Washing buffer以及含有50-200μg IgG的样品溶液加入到过滤管中。a)
(2)8,000-10,000g离心10分钟后,加入100μl Washing buffer再离心一次。b)
(3)将10μl Reaction buffer加入到NH2-reactive peroxidase中并用移液器吹打使其溶解。
(4)将含有NH2-reactive peroxidase的溶液转移到IgG所集中的过滤管的滤膜上。
(5)用移液器吸取溶液吹吸净整个滤膜表面,然后将过滤管放入培养箱中,37℃培养2小时。
(6)将100μl Washing buffer加入到过滤管中。如果滤液的体积超过300μl,在进行步骤7前需要先丢弃滤液。
(7)8,000-10,000g离心10分钟。b)
(8)加入200μl Storage buffer并用移液器吹打10到15次来回收标记产物。c) 将溶液转移至0.5ml的试管中,并储存于0-5℃下。d)
a)推荐的IgG的量为100μg,样品溶液的体积不应超过100μl。如果抗体浓度低于0.5mg/ml,重复步骤1和2直至总的IgG聚积量达到50-200μg。如果在聚积过程中,滤液体积达到或超过了400μl,则需在进行下一步离心前将滤液除去。
b)如果溶液在离心后仍然残留在膜上,可以再离心5分钟或者适当增加转速。
c)标记产物的浓度为0.5-1.3mg/ml。在进行后续的酶免疫,免疫印迹,免疫转染试验前先要将标记后的IgG稀释至适当的浓度。每个IgG分子上会被标记上1-3个辣根过氧化物酶分子。没有被结合的辣根过氧化物酶不会干扰正常的免疫试验。如果一定要纯化的话,可以使用凝胶渗透柱或亲合柱。
d)通常,辣根过氧化物酶标记后的IgG在Storage buffer中,0-5℃下至少能够保存2个月,如果需要保存更久,可以添加等量的丙三醇(终浓度:50%),并在-20℃下存放。但是,还要注意样品自身是否稳定。
标记小分子操作步骤:
(1)用Reaction buffer制备50μl,1mM的氨基化合物,a)并将该溶液加入到NH2-reactive peroxidase管中。吹打数次使其充分混合,然后置于37℃下培养1小时。
(2)将100μl Washing buffer加入到反应液中并将整个溶液全部移入过滤管中。
(3)在8,000-10,000g离心10分钟,b)弃滤液,向管中加入200μl Washing buffer。再重复该过程一次,然后再在8,000-10,000g离心10分钟。b)
(4)加入200μl Storage buffer并用移液器吹打10到15次来回收抗体。c)将溶液转移至0.5ml的试管中,并储存于0-5℃下。d)
a)如果氨基化合物在水溶液中无法溶解,可以用DMSO使其溶解,制备成10mM的溶液,取5μl与45μl Reaction buffer混合。
b)如果溶液在离心后仍然残留在膜上,可以再离心5分钟或者适当增加转速。
c)标记产物的浓度大约为400-500μg/ml (10-12.5μM)。1-2个靶分子能够和1个辣根过氧化物酶分子结合。
d)标记后的小分子在0-5℃下能够存放至少6个月。
产品优势
1)POD标记的产品可以在大约3个小时内制备。
2)可以标记高分子量化合物(MW> 50,000)和低分子量化合物(MW <5,000)。
3)可以标记50至200μg的蛋白质。
4)POD标记的产品只需与NH2-反应性过氧化物酶混合即可形成。
5)可以通过使用过滤管的分离操作以高回收率获得标记物质。
6)POD标签可以用随附的保存溶液保存。
常见问题Q&A
| Q1: 标记反应结束后,未反应的NH2-reactive peroxdase是否还具有活性? |
| A:没有了。它在反应过程中会完全被水解。 |
| Q2: 标记反应过程中,NH2-reactive peroxdase是否会形成一些低聚物? |
| A:不会。由于NH2-reactive peroxdase中的所有氨基都被阻断,因此不会有低聚物生成。 |
| Q3: 是否必须要使用试剂盒所包含的Storage Buffer? |
| A:不一定要使用试剂盒所包含的Storage Buffer。可以选择任何适用于该实验的缓冲液。但是,Storage Buffer能够提高标记产物的稳定性。 |
| Q4:Storage Buffer中是否含有动物产品或者高分子聚合物? |
| A:Storage Buffer中不含有任何动物产品,高分子聚合物或者重金属离子。 |
| Q5: 能够使用这个试剂盒标记Fab或者Fab’吗? |
| A:可以标记。并且回收率通常都超过80%。 |
| Q6:能够用这个试剂盒标记其它蛋白质吗? |
| A:可以。只要标记分子的分子量>50,000或者<5,000且具有活性伯胺或仲胺结构。如果分子量>50,000,参照IgG的标记操作说明,使用0.5-1 nmol蛋白样品用LK11-10来标记。 如果分子量<5,000,参照标记小分子的操作说明。如果分子量>5,000且<50,000,请咨询我们的客户服务。Email:info@dojindo.cn 免费电话:800-988-0083 |
| Q7:能够使用这个试剂盒标记寡核苷酸或者寡肽吗? |
| A:可以。只要它的分子量小于5,000且具有活性伯胺或仲胺。可以参照标记小分子的操作说明。 |
| Q8:LK11所能标记的最小的IgG的量是多少? |
| A:最小量为50 μg。标记50 μg与200 μg之间的IgG,在灵敏度和本底上没有太大的区别。尽管这个试剂盒也能标记10 μg的IgG,但是本底会较高。 |
| Q9:每个IgG能够标记多少辣根过氧化物酶分子? |
| A:每个IgG平均能标记上1-3个辣根过氧化物酶分子。 |
参考文献
1) 広田次郎, 清水眞也, “キットを用いたモノクローナル抗体への迅速・簡便なペルオキシダーゼ標識法”, 動物衛生研究所研究報告, 2005, 111, 37.
2) A. Miyagawa-Yamaguchi, N. Kotani, and K. Honke, “Expressed Glycosylphosphatidylinositol-Anchored Horseradish Peroxidase Identifies Co-Clustering Molecules in Individual Lipid Raft Domains”, PLoS ONE., 2014, 9, (3), e93054.
3) J. Zhang, D. Klufas, K. Manalo, K. Adjepong, J.O. Davidson, G. Wassink, L. Bennet, A.J. Gunn, E.G. Stopa, K. Liu, M. Nishibori, and B.S. Stonestreet, “HMGB1 Translocation After Ischemia in the Ovine Fetal Brain”, J. Neuropathol. Exp. Neurol.., 2016, 75, (6), 527.
4) M. Okumura, T. Ozawa, H. Hamana, Y. Norimatsu, R. Tsuda, E. Kobayashi, K. Shinoda, H. Taki, K. Tobe, J. Imura, E. Sugiyama, H. Kishi, and A. Muraguchi, “Autoantibodies reactive to PEP08 are clinically related with morbidity and severity of interstitial lung disease in connective tissue diseases”, Eur. J. Immunol.., 2018, 48, (10), 1717.
5) R. Sugisawa, G. Komatsu, E. Hiramoto, N. Takeda, K. Yamamura, S. Arai, and T. Miyazaki, “Independent modes of disease repair by AIM protein distinguished in AIM-felinized mice”, Sci. Rep.., 2018, 8, 13157.
6) S. Takatsuka, T. Inukai, S. Kawakubo, T. Umeyama, M. Abe, K. Ueno, Y. Hoshino, Y. Kinjo, Y. Miyazaki, and S. Yamagoe, “Identification of a Novel Variant Form of Aspergillus fumigatus CalC and Generation of Anti-CalC Monoclonal Antibodies”, Med Mycol J., 2019, 60, (1), 11.
7) T. Sasaki, K. Liu,T. Agari, T. Yasuhara, J. Morimoto, M. Okazaki, H. Takeuchi, A. Toyoshima, S. Sasada, A. Shinko, A. Kondo, M. Kameda, I. Miyazaki, M. Asanuma, CV. Borlongan, M. Nishibori, and I. Date, “Anti-high mobility group box 1 antibody exerts neuroprotection in a rat model of Parkinson’s disease”, Exp. Neurol.., 2016, 275, 220.
8) T. Tsumuraya, I. Fujii, M. Inoue, A. Tatami, K. Miyazaki, and M. Hirama, “Production of monoclonal antibodies for sandwich immunoassay detection of ciguatoxin 51-hydroxyCTX3C”, Toxicon., 2006, 48, (3), 287.
9) W. Jin, K. Yamada, M. Ikami, N. Kaji, M. Tokeshi, Y. Atsumi, M. Mizutani, A. Murai, A. Okamoto, T. Namikaw, Y. Baba, and M. Ohta, “Application of IgY to sandwich enzyme-linked immunosorbent assays, lateral flow devices, and immunopillar chips for detecting staphylococcal enterotoxins in milk and dairy products”, J. Microbiol. Methods., 2013, 92, (3), 323.
10) W.W.P.N. Weerakoon, M. Sakase, N. Kawate, M.A. Hannan, N. Kohama, and H. Tamada, “Plasma IGF-I, INSL3, testosterone, inhibin concentrations and scrotal circumferences surrounding puberty in Japanese Black beef bulls with normal and abnormal semen”, Theriogenology., 2018, 114, (1), 54.
11) Y. Watanabe, Y. Kazuki, K. Kazuki, M. Ebiki, M. Nakanishi, K. Nakamura, M. Yoshida Yamakawa,H. Hosokawa, T. Ohbayashi, M. Oshimura, and K. Nakashima, “Use of a Human Artificial Chromosome for Delivering Trophic Factors in a Rodent Model of Amyotrophic Lateral Sclerosis”, Mol Ther Nucleic Acids., 2015, 4, (10), e253.
12) Y.S. Kim, D.H. Jung, I.S. Lee, B.J. Pyun and J.S. Kim, “Osteomeles schwerinae extracts inhibits the binding to receptors of advanced glycation end products and TGF-β1 expression in mesangial cells under diabetic conditions”, Phytomedicine., 2016, 23, (4), 388.
13) S .Kon, M. Honda, K. Ishikawa, M. Maeda and T. Segawa, “Antibodies against nephronectin ameliorate anti-type II collagen-induced arthritis in mice.’, FEBS Open Bio., 2019,10.1002/2211-5463.12758.
Streptavidin, Horseradish Peroxidase辣根过氧化物酶标记的链亲和素
Avidin and streptavidin reagents are powerful tools to detect or purify biotinylated proteins, nucleic acids, and other macromolecules.
Vector Laboratories’ enzyme-conjugated avidin and streptavidin are produced with the highest specific activity enzymes in optimal ratios. Specific covalent linkages are chosen to provide stable, highly active conjugates.
These enzyme conjugates are suitable for use in solid-phase assays, tissue/cell staining systems, and blotting applications.
Horseradish Peroxidase Streptavidin is produced by our own coupling procedure which preserves the high specific activity of the peroxidase. Using biotinylated primary or secondary intermediates and peroxidase-labeled streptavidin, antigens can be localized in histological sections, cytospin preparations, or smears. In addition, sensitive detection systems for a variety of solid-phase assays utilizing microtitration plates or nitrocellulose have been developed using this conjugate. Horseradish Peroxidase Streptavidin is supplied as a concentrate (1mg/ml) or as a ready-to-use (R.T.U.) stabilized solution (100 ml, 1µg/ml) in a bottle fitted with a drop dispenser top.
CERTIFICATE OF ANALYSIS
Product R.T.U HORSERADISH PEROXIDASE STREPTAVIDIN
Catalog No. SA-5704
Amount 100 ml
Lot No. X1103
Concentration 1.0 μg/ml active conjugate*
1.5
Molar ratio of active conjugate
Storage Conditions Refrigerate; DO NOT FREEZE
* This product is provided at a ready-to-use concentration in a solution which
preserves the activity on the conjugate when stored as recommended.
For most applications the recommended incubation time is 30 minutes.
Do not use sodium azide with this product since it is an inhibitor of horseradish
peroxidase.
FOR LABORATORY USE.
Streptavidin, Horseradish Peroxidase, R.T.U.
Avidin and streptavidin reagents are powerful tools to detect or purify biotinylated proteins, nucleic acids, and other macromolecules.
Vector Laboratories’ enzyme-conjugated avidin and streptavidin are produced with the highest specific activity enzymes in optimal ratios. Specific covalent linkages are chosen to provide stable, highly active conjugates.
These enzyme conjugates are suitable for use in solid-phase assays, tissue/cell staining systems, and blotting applications.
Horseradish Peroxidase Streptavidin is produced by our own coupling procedure which preserves the high specific activity of the peroxidase. Using biotinylated primary or secondary intermediates and peroxidase-labeled streptavidin, antigens can be localized in histological sections, cytospin preparations, or smears. In addition, sensitive detection systems for a variety of solid-phase assays utilizing microtitration plates or nitrocellulose have been developed using this conjugate. Horseradish Peroxidase Streptavidin is supplied as a concentrate (1mg/ml) or as a ready-to-use (R.T.U.) stabilized solution (100 ml, 1µg/ml) in a bottle fitted with a drop dispenser top.
上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 3 samples | ¥21,300 | 345-90831 |
| サンプル量 | 50-200 µg |
|---|---|
| 所要時間 | 3時間 |
| 標識部位 | -SH |
| 検出方法 | 顕微鏡・ウエスタンブロット・プレートリーダー |
| 基質 | TMB,DAB等 |
|
・高分子化合物(MW>50,000)および低分子化合物(MW<5,000)を標識できる。 ・SH-Reactive Peroxidaseと混合するだけでPOD標識体を形成する。 ・付属の還元剤を用いることで遊離SH基を持たないタンパク質への標識も可能である*。 ・Filtration tubeを用いた分離操作により高い回収率で標識体が得られる。 ・付属の保存溶液でPOD標識体の保存ができる。 |
|

| 3 samples | ・SH-Reactive Peroxidase ・Reducing Agent ・Solution A ・Solution B ・Reaction Buffer ・Storage Buffer ・Filtration Tube |
3 tubes 3 tubes 4 ml ×1 1 ml ×1 200 μl ×1 4 ml ×1 3 tubes |
|---|
Peroxidase Labeling Kit – SHの使い方
1) 約3時間でPOD標識体が調製できる。
2) 高分子化合物(MW>50,000)および低分子化合物(MW<5,000)を標識できる。
3)50~200 μgのタンパク質を標識可能である。
4) SH-Reactive Peroxidaseと混合するだけでPOD標識体を形成する。
5) 付属の還元剤を用いることで遊離SH基を持たないタンパク質への標識も可能である*。
6) Filtration tubeを用いた分離操作により高い回収率で標識体が得られる。
7) 付属の保存溶液でPOD標識体の保存ができる。
1) 広田次郎, 清水眞也, "キットを用いたモノクローナル抗体への迅速・簡便なペルオキシダーゼ標識法", 動物衛生研究所研究報告, 2005, 111, 37.
2) K. Inoue, A. Sugiyama, P. C. Reid, Y. Ito, K. Miyauchi, S. Mukai, M. Sagara, K. Miyamoto, H. Satoh, I. Kohno, T. Kurata, H. Ota, A. Mantovani, T. Hamakubo, H. Daida and T. Kodama, "Establishment of a High Sensitivity Plasma Assay for Human Pentraxin3 as a Marker for Unstable Angina Pectoris", Arterioscler. Thromb. Vasc. Biol., 2007, 27, 161.
3) N. Esaki, Y. Ohkawa, N. Hashimoto, Y. Tsuda, Y. Ohmi, R. H. Bhuiyan, N. Kotani, K. Honke, A. Enomoto, M. Takahashi, K. Furukawa, and K. Furukawa, "ASC amino acid transporter 2, defined by enzyme-mediated activation of radical sources, enhances malignancy of GD2-positive small-cell lung cancer.", Cancer Sci.., 2018, 109, (1), 141.
4) G.W.Zhanga, S.J.Lai, Y.Yoshimura, and N.Isobe, "Messenger RNA expression and immunolocalization of psoriasin in the goat mammary gland and its milk concentration after an intramammary infusion of lipopolysaccharide", Vet. J.., 2014, 202, (1), 89.
5) G-W. Zhang, S-J. Lai, Y. Yoshimura, and N. Isobe, "Expression of cathelicidins mRNA in the goat mammary gland and effect of the intramammary infusion of lipopolysaccharide on milk cathelicidin-2 concentration", Vet. Microbiol.., 2014, 170, (1-2), 125.
6) H. Tateno, S. Saito, K. Hiemori, K. Kiyoi, K. Hasehira, M. Toyoda, Y. Onuma, Y. Ito, H. Akutsu, and J. Hirabayashi, "α2–6 sialylation is a marker of the differentiation potential of human mesenchymal stem cells", Glycobiology., 2016, 26, (12), 1328.
7) K. Iizumi, H. Kawasaki, A. Shigenaga, M. Tominaga, A. Otsu, A. Kamo, Y. Kamata, K. Takamori, and F. Yamakura, "Tryptophan nitration of immunoglobulin light chain as a new possible biomarker for atopic dermatitis", J Clin Biochem Nutr., 2018, 63, (3), 197.
8) K. Morioka, K. Fukai, K. Yoshida, R. Yamazoe, H. Onozato, S. Ohashi, T. Tsuda, and K. Sakamoto, "Foot-and-Mouth Disease Virus Antigen Detection Enzyme-Linked Immunosorbent Assay Using Multiserotype-Reactive Monoclonal Antibodies", J. Clin. Microbiol.., 2009, 47, (11), 3663.
9) M. Watanabe, I. Takemasa, N. Kaneko, Y. Yokoyama, E. Matsuo, S. Iwasa, M. Mori, N. Matsuura, M. Monden, and O. Nishimura, "Clinical significance of circulating galectins as colorectal cancer markers", Oncol. Rep.., 2011, 25, (5), 1217.
10) M. Yasunaga, S. Saijou, S. Hanaoka, T. Anzai, R. Tsumura, and Y. Matsumura, "Significant antitumor effect of an antibody against TMEM180, a new colorectal cancer‐specific molecule", Cancer Sci.., 2019, 110, (2), 761.
11) N. Esaki, Y. Ohkawa, N. Hashimoto, Y. Tsuda, Y. Ohmi, R. H. Bhuiyan, N. Kotani, K. Honke, A. Enomoto, M. Takahashi, K. Furukawa, and K. Furukawa, "ASC amino acid transporter 2, defined by enzyme‐mediated activation of radical sources, enhances malignancy of GD2‐positive small‐cell lung cancer", Cancer Sci.., 2018, 109, (1), 141.
12) N. Hashimoto, K. Hamamura, N. Kotani, K. Furukawa, K. Kaneko, K. Honke, and K. Furukawa,  "Proteomic analysis of ganglioside‐associated membrane molecules: Substantial basis for molecular clustering", Proteomics., 2012, 12, (21), 3154.
"Proteomic analysis of ganglioside‐associated membrane molecules: Substantial basis for molecular clustering", Proteomics., 2012, 12, (21), 3154.
13) N. Kotani, Y. Ida, T. Nakano, I. Sato, R. Kuwahara, A. Yamaguchi, M. Tomita, K. Honke, and T. Murakoshi, "Tumor-dependent secretion of close homolog of L1 results in elevation of its circulating level in mouse model for human lung tumor", Biochem. Biophys. Res. Commun.., 2018, 501, (4), 982.
14) R. Yamashita, N. Kotani, Y. Ishiura, S. Higashiyama, and K. Honke, "Spatiotemporally-regulated interaction between β1 integrin and ErbB4 that is involved in fibronectin-dependent cell migration", J. Biol. Chem.., 2011, 149, (3), 347.
15) T. Noro, E. Oishi, T. Kaneshige, K. Yaguchi, K. Amimoto, and M. Shimizu, "Identification and characterization of haemagglutinin epitopes of Avibacterium paragallinarum serovar C", Vet. Microbiol.., 2008, 131, (3-4), 406.
16) K. Okada, H. Itoh and M. Ikemotob, "Circulating S100A8/A9 is potentially a biomarker that could reflect the severity of experimental colitis in rats', Heliyon, 2020, 6, (2), e03470.
Labeling Kitで1次抗体を直接標識する利点を教えてください。
はじめて抗体標識をされる方を対象としたプロトコルを作成しております。
カスタマーサポートの視点から直接標識法の利点や実施例等を記載しておりますので、ご参照下さい。
下記リンクよりダウンロード可能です。
「はじめての抗体標識プロトコル ~カスタマーサポートの視点から~」
サンプル溶液中の共存物は反応に影響しますか?
共存物の種類により影響することがあります。
溶液中にどのような物質が含まれるかを確認の上、状況に応じてラベル化に用いるサンプルの精製を行い、標識反応にご使用ください。
<高分子:分子量1万以上>
影響する可能性があります。
高分子でSH基をもつ化合物は、Filtration Tubeでも除くことができません。 そのため標識され、蛍光性不純物として影響します。反応に使用する前に別途精製を行ってください。 一方、SH基を持たない化合物でも、高分子の不純物が多いとフィルターの目詰まりの原因になり、標識・精製操作に支障がでる可能性もあります。
*本製品に限らず他のLabeling kit に関しても同様の注意が必要です。
使用できるIgGの量が少量しかありませんが標識できますか?
本キットでは、標識に必要なIgGの量は50~200 μgとしています。
この範囲であれば性能に大きな違いはありません。
10 μgのIgGでも標識可能ですが、バックグランドの上昇などの問題が生じる可能性があります。
サンプルは溶液になっていても問題ないでしょうか?
問題ありません。
但し、添付のFilitration tubeの容量に制限がありますので、サンプル溶液の容量は100 μl以下である必要があります。
また、サンプルの濃度が0.5 mg/mL以下(50 μg/100 μL以下)である場合は、Filitration tubeを用いてサンプル量が50~200 μgとなるようにして下さい。
溶液をFilitration tubeにいれて遠心して溶液を除く操作を行って下さい(必要であれば繰り返す)。
フィルター上に残っているサンプルの量が50~200 μgとなればよいので、改めて溶解させる必要はありません。
*注:低分子の阻害物質は最初の段階で除かれますが、高分子(分子量1万以上)の阻害物質(例;BSA、ゼラチン)は除くことが出来ません。使用前に別途除去してください。
低分子のタンパク質(分子量50,000以下)に標識する場合の方法を教えて下さい。
キット付属のフィルトレーションチューブは分画分子量30Kの限外濾過フィルターのため、余裕をもって50,000以上のタンパク質のご使用を推奨しております。
分子量50,000以下のタンパク質を標識される場合は、下記のような分画分子量の小さい限外濾過フィルターに変更して頂くことで、低分子のタンパク質でもラベル化可能でございます。
——————————————————————-
PALL社 ナノセップ 3K 製品No.OD003C33
PALL社 ナノセップ 10K 製品No.OD010C33
——————————————————————-
キット同梱のフィルターを用いた場合に比べ遠心に時間を要することがございますので遠心時間はご検討下さい。
どのようなものが標識できますか?
分子量が「50,000以上」で[S-S]もしくは[SH]を有しているもの、分子量が「5,000以下」で[SH]を有している化合物(抗体、蛋白質など)であれば標識できます。
分子量が「5,000以下」、「50,000以上」で操作方法が若干異なりますので、製品に添付の説明書をご覧いただき標識反応を行ってください。
IgG 1分子に対して、どれくらいのPeroxidaseが標識されますか?
IgG 1分子に対して平均2~4分子のPeroxidaseが標識されます。
標識率は出せますか?
標識後のサンプル溶液には、未反応のReactive体が含まれるため標識率を算出することはできません。


| 保存条件: 冷蔵 , 取扱条件: 吸湿注意 |

この製品に関連する研究では、下記の関連製品も使われています。
Peroxidase Labeling Kit – NH2
Ab-10 Rapid Peroxidase Labeling Kit
上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 Peroxidase Labeling Kit – NH2
Peroxidase Labeling Kit – NH2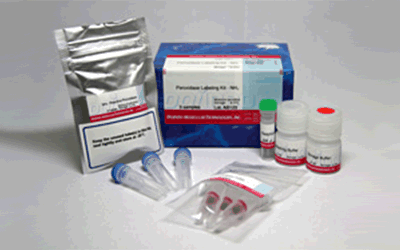
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 3 samples | ¥21,300 | 348-90821 |
| サンプル量 | 50-200 µg |
|---|---|
| 所要時間 | 3時間 |
| 標識部位 | -NH2 |
| 検出方法 | 顕微鏡・ウエスタンブロット・プレートリーダー |
| 基質 | TMB, DAB等 |
|
・高分子化合物(MW>50,000)および低分子化合物(MW<5,000)を標識できる。 ・NH2-Reactive Peroxidaseと混合するだけでPOD標識体を形成する。 ・Filtration tubeを用いた分離操作により高い回収率で標識体が得られる。 ・付属の保存溶液でPOD標識体の保存ができる。 |
|

| 3 samples | ・NH2-Reactive Peroxidase ・Washing Buffer ・Reaction Buffer ・Storage Buffer ・Filtration Tube |
3 tubes 4 ml x1 200 μl x1 4 ml x1 3 tubes |
|---|


Peroxidase Labeling Kit – NH2の使い方
1) 約3時間以内にPOD標識体が調製できる。
2) 高分子化合物(MW>50,000)および低分子化合物(MW<5,000)を標識できる。
3)50~200 μgのタンパク質を標識可能である。
4) NH2-Reactive Peroxidaseと混合するだけでPOD標識体を形成する。
5) Filtration Tubeを用いた分離操作により高い回収率で標識体が得られる。
6) 付属の保存溶液でPOD標識体の保存ができる。
1) 広田次郎, 清水眞也, "キットを用いたモノクローナル抗体への迅速・簡便なペルオキシダーゼ標識法", 動物衛生研究所研究報告, 2005, 111, 37.
2) A. Miyagawa-Yamaguchi, N. Kotani, and K. Honke, "Expressed Glycosylphosphatidylinositol-Anchored Horseradish Peroxidase Identifies Co-Clustering Molecules in Individual Lipid Raft Domains", PLoS ONE., 2014, 9, (3), e93054.
3) J. Zhang, D. Klufas, K. Manalo, K. Adjepong, J.O. Davidson, G. Wassink, L. Bennet, A.J. Gunn, E.G. Stopa, K. Liu, M. Nishibori, and B.S. Stonestreet, "HMGB1 Translocation After Ischemia in the Ovine Fetal Brain", J. Neuropathol. Exp. Neurol.., 2016, 75, (6), 527.
4) M. Okumura, T. Ozawa, H. Hamana, Y. Norimatsu, R. Tsuda, E. Kobayashi, K. Shinoda, H. Taki, K. Tobe, J. Imura, E. Sugiyama, H. Kishi, and A. Muraguchi, "Autoantibodies reactive to PEP08 are clinically related with morbidity and severity of interstitial lung disease in connective tissue diseases", Eur. J. Immunol.., 2018, 48, (10), 1717.
5) R. Sugisawa, G. Komatsu, E. Hiramoto, N. Takeda, K. Yamamura, S. Arai, and T. Miyazaki, "Independent modes of disease repair by AIM protein distinguished in AIM-felinized mice", Sci. Rep.., 2018, 8, 13157.
6) S. Takatsuka, T. Inukai, S. Kawakubo, T. Umeyama, M. Abe, K. Ueno, Y. Hoshino, Y. Kinjo, Y. Miyazaki, and S. Yamagoe, "Identification of a Novel Variant Form of Aspergillus fumigatus CalC and Generation of Anti-CalC Monoclonal Antibodies", Med Mycol J., 2019, 60, (1), 11.
7) T. Sasaki, K. Liu,T. Agari, T. Yasuhara, J. Morimoto, M. Okazaki, H. Takeuchi, A. Toyoshima, S. Sasada, A. Shinko, A. Kondo, M. Kameda, I. Miyazaki, M. Asanuma, CV. Borlongan, M. Nishibori, and I. Date, "Anti-high mobility group box 1 antibody exerts neuroprotection in a rat model of Parkinson's disease", Exp. Neurol.., 2016, 275, 220.
8) T. Tsumuraya, I. Fujii, M. Inoue, A. Tatami, K. Miyazaki, and M. Hirama, "Production of monoclonal antibodies for sandwich immunoassay detection of ciguatoxin 51-hydroxyCTX3C", Toxicon., 2006, 48, (3), 287.
9) W. Jin, K. Yamada, M. Ikami, N. Kaji, M. Tokeshi, Y. Atsumi, M. Mizutani, A. Murai, A. Okamoto, T. Namikaw, Y. Baba, and M. Ohta, "Application of IgY to sandwich enzyme-linked immunosorbent assays, lateral flow devices, and immunopillar chips for detecting staphylococcal enterotoxins in milk and dairy products", J. Microbiol. Methods., 2013, 92, (3), 323.
10) W.W.P.N. Weerakoon, M. Sakase, N. Kawate, M.A. Hannan, N. Kohama, and H. Tamada, "Plasma IGF-I, INSL3, testosterone, inhibin concentrations and scrotal circumferences surrounding puberty in Japanese Black beef bulls with normal and abnormal semen", Theriogenology., 2018, 114, (1), 54.
11) Y. Watanabe, Y. Kazuki, K. Kazuki, M. Ebiki, M. Nakanishi, K. Nakamura, M. Yoshida Yamakawa,H. Hosokawa, T. Ohbayashi, M. Oshimura, and K. Nakashima, "Use of a Human Artificial Chromosome for Delivering Trophic Factors in a Rodent Model of Amyotrophic Lateral Sclerosis", Mol Ther Nucleic Acids., 2015, 4, (10), e253.
12) Y.S. Kim, D.H. Jung, I.S. Lee, B.J. Pyun and J.S. Kim, "Osteomeles schwerinae extracts inhibits the binding to receptors of advanced glycation end products and TGF-β1 expression in mesangial cells under diabetic conditions", Phytomedicine., 2016, 23, (4), 388.
13) S .Kon, M. Honda, K. Ishikawa, M. Maeda and T. Segawa, "Antibodies against nephronectin ameliorate anti-type II collagen-induced arthritis in mice.', FEBS Open Bio., 2019,10.1002/2211-5463.12758.
14) S. Furutani, K. Nishio, N. Naruishi, Y. A. Ogawa, Y. Hagihara, Y. Yoshida and H. Nagai, "Rapid Enzyme-linked Immunosorbent Assays for Diagnosis of Diabetes in a Compact Disc-shaped Microfluidic Device.', Anal. Sci., 2018, 34, (4), 379.
15) H. Takashima, Y. Koga, R. Tsumura, M. Yasunaga, M. Tsuchiya, T. Inoue, E. Negishi, M. Harada, S. Yoshida and Y. Matsumura, "Reinforcement of antitumor effect of micelles containing anticancer drugs by binding of an anti-tissue factor antibody without direct cytocidal effects.', J Control Release, 2020, 35, (5), e2866.
16) H. Takashima, Y. Koga, R. Tsumura, M. Yasunaga, M. Tsuchiya, T. Inoue, E. Negishi, M. Harada, S. Yoshida and Y. Matsumura, "Reinforcement of antitumor effect of micelles containing anticancer drugs by binding of an anti-tissue factor antibody without direct cytocidal effects.', J Control Release, 2020, 35, (5), e2866.
17) H. Takashima, Y. Koga, R. Tsumura, M. Yasunaga, M. Tsuchiya, T. Inoue, E. Negishi, M. Harada, S. Yoshida and Y. Matsumura, "Reinforcement of antitumor effect of micelles containing anticancer drugs by binding of an anti-tissue factor antibody without direct cytocidal effects.', J Control Release, 2020, 35, (5), e2866.
Labeling Kitで1次抗体を直接標識する利点を教えてください。
はじめて抗体標識をされる方を対象としたプロトコルを作成しております。
カスタマーサポートの視点から直接標識法の利点や実施例等を記載しておりますので、ご参照下さい。
下記リンクよりダウンロード可能です。
「はじめての抗体標識プロトコル ~カスタマーサポートの視点から~」
サンプル溶液中の共存物は反応に影響しますか?
共存物の種類により影響することがあります。
溶液中にどのような物質が含まれるかを確認の上、状況に応じてラベル化に用いるサンプルの精製を行い、標識反応にご使用ください。
<高分子:分子量1万以上>
影響する可能性があります。
BSAやゼラチンなどアミノ基をもつ化合物が含まれると、抗体への標識効率が低下します。また、高分子のためFiltration Tubeでも除くことができません。また、アミノ基を持たない化合物でも、高分子の不純物が多いとフィルターの目詰まりの原因になり、標識・精製操作に支障がでる可能性もあります。反応に使用する前に別途精製を行ってください。
*本製品に限らず他のLabeling kit に関しても同様の注意が必要です。
使用できるIgGの量が少量しかありませんが標識できますか?
本キットでは、標識に必要なIgGの量は50~200 μgとしています。
この範囲であれば性能に大きな違いはありません。
10 μgのIgGでも標識可能ですが、バックグランドの上昇などの問題が生じる可能性があります。
サンプルは溶液になっていても問題ないでしょうか?
問題ありません。
但し、添付のFilitration tubeの容量に制限がありますので、サンプル溶液の容量は100 μl以下である必要があります。
また、サンプルの濃度が0.5 mg/mL以下(50 μg/100 μL以下)である場合は、Filitration tubeを用いてサンプル量が50~200 μgとなるようにして下さい。
溶液をFilitration tubeにいれて遠心して溶液を除く操作を行って下さい。(必要であれば繰り返す。)フィルター上に残っているサンプルの量が50~200 μgとなればよいので、改めて溶解させる必要はありません。
*注:低分子の阻害物質は最初の段階で除かれますが、高分子(分子量1万以上)の阻害物質(例;BSA、ゼラチン)は除くことが出来ません。使用前に別途除去してください。
低分子のタンパク質(分子量50,000以下)に標識する場合の方法を教えて下さい。
キット付属のフィルトレーションチューブは分画分子量30Kの限外濾過フィルターのため、余裕をもって50,000以上のタンパク質のご使用を推奨しております。
分子量50,000以下のタンパク質を標識される場合は、下記のような分画分子量の小さい限外濾過フィルターに変更して頂くことで、低分子のタンパク質でもラベル化可能でございます。
——————————————————————
PALL社 ナノセップ 3K 製品No.OD003C33
PALL社 ナノセップ 10K 製品No.OD010C33
——————————————————————
キット同梱のフィルターを用いた場合に比べ遠心に時間を要することがございますので遠心時間はご検討下さい。
どのようなものが標識できますか?
分子量が「5,000以下」もしくは「50,000以上」で反応性のアミノ基(NH2)を有している
化合物(抗体、蛋白質など)であれば標識できます。
分子量が「5,000以下」、「50,000以上」で操作方法が若干異なりますので、製品に添付の説明書をご覧いただき標識反応を行ってください。
IgG 1分子に対して、どれくらいのPeroxidaseが標識されますか?
IgG 1分子に対して平均1~3分子のPeroxidaseが標識されます。


| 保存条件: 冷蔵 , 取扱条件: 吸湿注意 |

この製品に関連する研究では、下記の関連製品も使われています。
Peroxidase Labeling Kit – SH
Ab-10 Rapid Peroxidase Labeling Kit
上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 Ab-10 Rapid Peroxidase Labeling Kit
Ab-10 Rapid Peroxidase Labeling Kit
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 3 samples | ¥21,600 | 340-91861 |
| サンプル量 | 10 µg(IgG) |
|---|---|
| 所要時間 | 30分以内 |
| 標識部位 | -NH2 |
| 検出方法 | 顕微鏡・ウエスタンブロット・プレートリーダー |
| 基質 | TMB, DAB等 |

| 3 samples | ・Reactive Peroxidase ・Reaction Buffer ・Stop Solution |
3 100 μl ×1 100 μl ×1 |
|---|


1) 少量抗体 (10 μg) でペルオキシダーゼ標識抗体を調製できる。
2) 抗体と混ぜるだけで標識できる。
3) 30分以内に標識できる。
1) A. R. A Moghani, M. K. Sharma and Y. Matsumoto, In cellulo phosphorylation of DNA double-strand break repair protein XRCC4 on Ser260 by DNA-PK.", J. Radiat. Res.., 2018, 59, 700.
2) K. Hitachi, M. Nakatani, A. Takasaki, Y. Ouchi, A. Uezumi, H. Ageta, H. Inagaki, H. Kurahashi and K. Tsuchida, "Myogenin promoter-associated lncRNA Myoparr is essential for myogenic differentiation..", EMBO Rep., 2019, 20, (3), doi: 10.15252/embr.201847468.
抗体溶液中に含まれる添加剤は標識反応に影響しますか?
抗体溶液中の添加剤によっては影響を受ける場合がございますので、ご使用前に必ず取り扱い説明書中の注意事項をご確認ください。
標識にはどのようなサンプルが使用できますか?
10 μgのIgG抗体をご使用頂けます。
使用可能な抗体のクラスには、どのようなものがありますか?
本製品はIgG抗体へ標識するよう最適化しています。IgG以外のクラス(IgMやIgA等)では標識実績はございません。
直接標識することで免疫染色に影響がみられた抗体種はありますか?
抗体の種類によっては直接標識法(1次抗体法)により抗原認識能を失うことがあります。抗原認識部位またはその近傍にアミノ基が存在した場合に、その部分に標識体が結合することで抗原認識能が低下することが考えられます。
弊社で確認した抗体のうち、直接標識することで免疫染色に問題が生じた抗体をご案内いたします。
| 抗体名 | 由来 | クローナリティ |
|---|---|---|
| Anti-VDAC1 antibody | Rabbit | ポリクローナル |
| Anti-EEA1 antibody | Rabbit | ポリクローナル |
| Anti-α-actin antibody | Mouse | モノクローナル |
| Anti-LAMP 1 antibody | Mouse | モノクローナル |
| Anti-Calnexin Antibody | Rabbit | ポリクローナル |


| 保存条件: 冷蔵 , 取扱条件: 吸湿注意 |

この製品に関連する研究では、下記の関連製品も使われています。
Peroxidase Labeling Kit – SH
Peroxidase Labeling Kit – NH2
Ab-10 Rapid Biotin Labeling Kit
Biotin Labeling Kit – NH2
上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
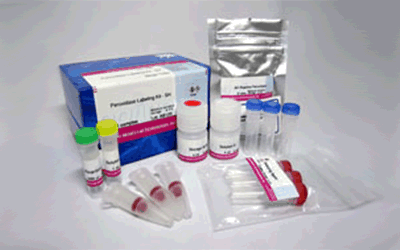
 Peroxidase Labeling Kit – NH2 (for 1mg)
Peroxidase Labeling Kit – NH2 (for 1mg)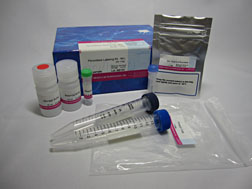
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 sample | ¥37,200 | 340-91121 |
| サンプル量 | 1 mg |
|---|---|
| 所要時間 | 3.5時間 |
| 標識部位 | -NH2 |
| 検出方法 | 顕微鏡・ウエスタンブロット・プレートリーダー |
| 基質 | TMB,DAB等 |
|
・高分子化合物(MW>50,000)および低分子化合物(MW<5,000)を標識できる。 ・NH2-Reactive Peroxidaseと混合するだけでPOD標識体を形成する。 ・Filtration tubeを用いた分離操作により高い回収率で標識体が得られる。 |
|

| 1 sample | ・NH2-Reactive Peroxidase ・Washing Buffer ・Reaction Buffer ・Storage Buffer ・Filtration Tube ・15 ml Tube (for counterbalance) |
1 tube 10 ml x1 1.2 ml x1 10 ml x1 1 tube 1 tube |
|---|


1) 1 mgのタンパク質を標識可能である。
2) 高分子化合物(MW>50,000)および低分子化合物(MW<5,000)を標識できる。
3)NH2-Reactive Peroxidaseと混合するだけでPOD標識体を形成する。
4) Filtration Tubeを用いた分離操作により高い回収率で標識体が得られる。
1) 広田次郎, 清水眞也, "キットを用いたモノクローナル抗体への迅速・簡便なペルオキシダーゼ標識法", 動物衛生研究所研究報告, 2005, 111, 37.
Labeling Kitで1次抗体を直接標識する利点を教えてください。
はじめて抗体標識をされる方を対象としたプロトコルを作成しております。
カスタマーサポートの視点から直接標識法の利点や実施例等を記載しておりますので、ご参照下さい。
下記リンクよりダウンロード可能です。
「はじめての抗体標識プロトコル ~カスタマーサポートの視点から~」
サンプル溶液中の共存物は反応に影響しますか?
共存物の種類により影響することがあります。
溶液中にどのような物質が含まれるかを確認の上、状況に応じてラベル化に用いるサンプルの精製を行い、標識反応にご使用ください。
<高分子:分子量1万以上>
影響する可能性があります。
BSAやゼラチンなどアミノ基をもつ化合物が含まれると、抗体への標識効率が低下します。また、高分子のためFiltration Tubeでも除くことができません。また、アミノ基を持たない化合物でも、高分子の不純物が多いとフィルターの目詰まりの原因になり、標識・精製操作に支障がでる可能性もあります。反応に使用する前に別途精製を行ってください。
*本製品に限らず他のLabeling kit に関しても同様の注意が必要です。


| 保存条件: 冷蔵 , 取扱条件: 吸湿注意 |

この製品に関連する研究では、下記の関連製品も使われています。
Peroxidase Labeling Kit – SH
Ab-10 Rapid Peroxidase Labeling Kit