上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
特点:
● 高特异性脂滴定位
● 可进行组织脂滴成像
● 多种颜色可供选择


产品解说
概述
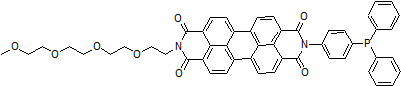
Lipi系列探针是高脂肪亲脂性小分子探针,其在疏水环境例如脂滴中发出强荧光。活细胞和固定细胞中的脂滴都可以使用本试剂清楚地观察。
原理
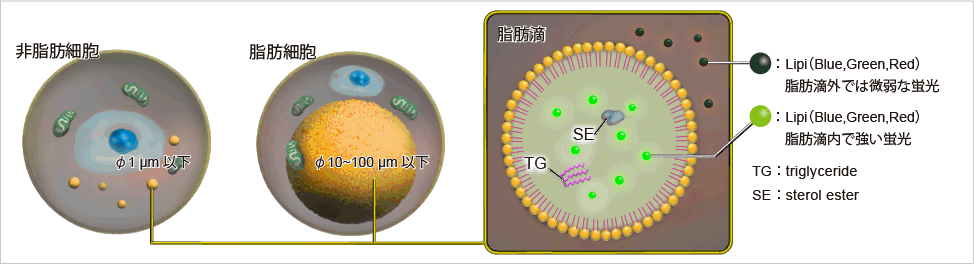
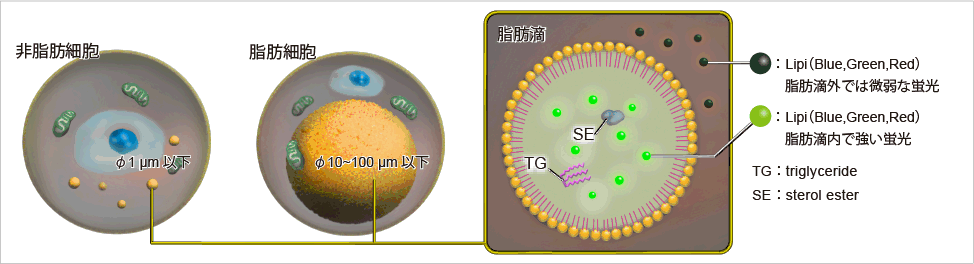
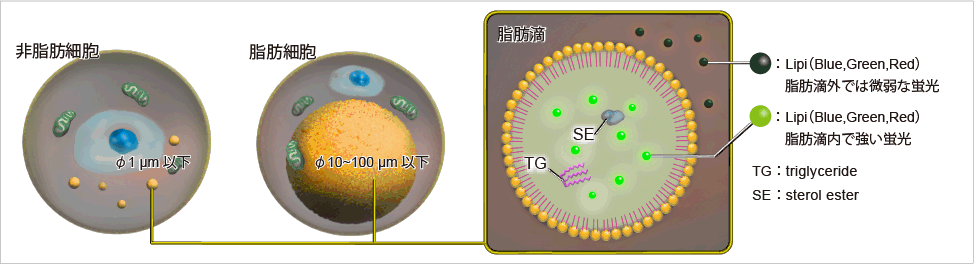
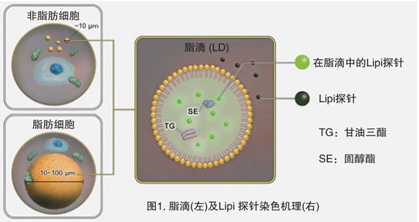
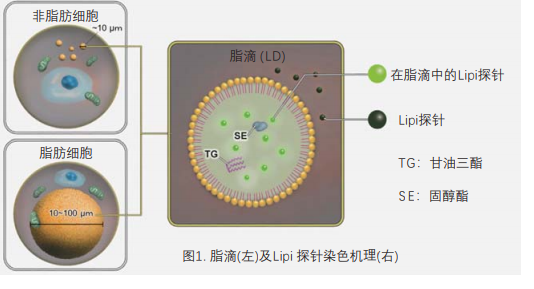
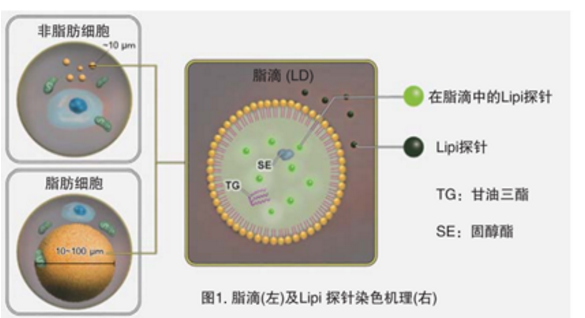
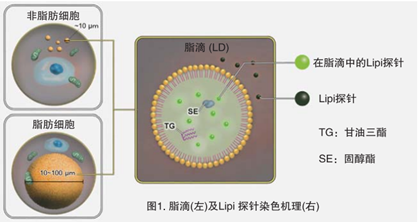
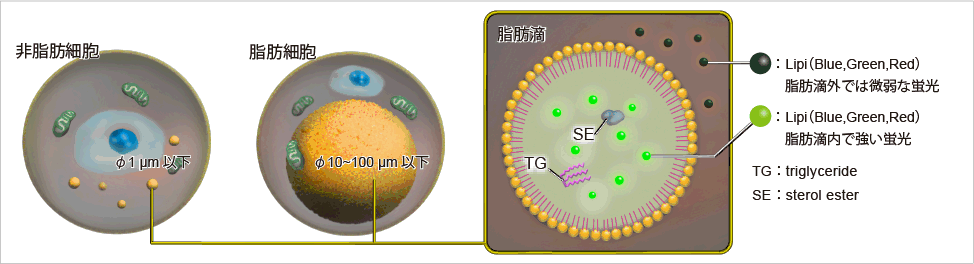
脂滴(脂肪滴,Lipid droplets, LDs)由中性脂肪组成,主要包括甘油三酯和胆固醇酯,其外层被一层单层磷脂分子包裹。而且脂滴不仅在脂肪细胞中存在,在真核生物中也普遍存在。最新的研究表明,以前认为脂滴仅是一个简单的脂质储存器,但最近的研究表明其在调节脂质代谢1),自噬2)和细胞衰老3)等方面都起着重要作用,因此需要进一步详细地研究脂滴形成·成长·融合·分解的机制。Lipi系列探针是高脂肪亲油性小分子探针,可在疏水环境例如脂滴中发出强荧光。Lipi探针染色后,无须洗涤即可观察到脂滴。
1) T. Fujimoto et al., “Lipid droplets: a classic organelle with new outfits.” Histochem Cell Biol., 2008, 130(2), 263.
2) R. Singh et al., “Autophagy regulates lipid metabolism.” Nature, 2009, 458(7242), 1131.
3) M. Yokoyama et al., “Inhibition of endothelial p53 improves metabolic abnormalities related to dietary obesity.” Cell Reports, 2014, 7(5), 1691.
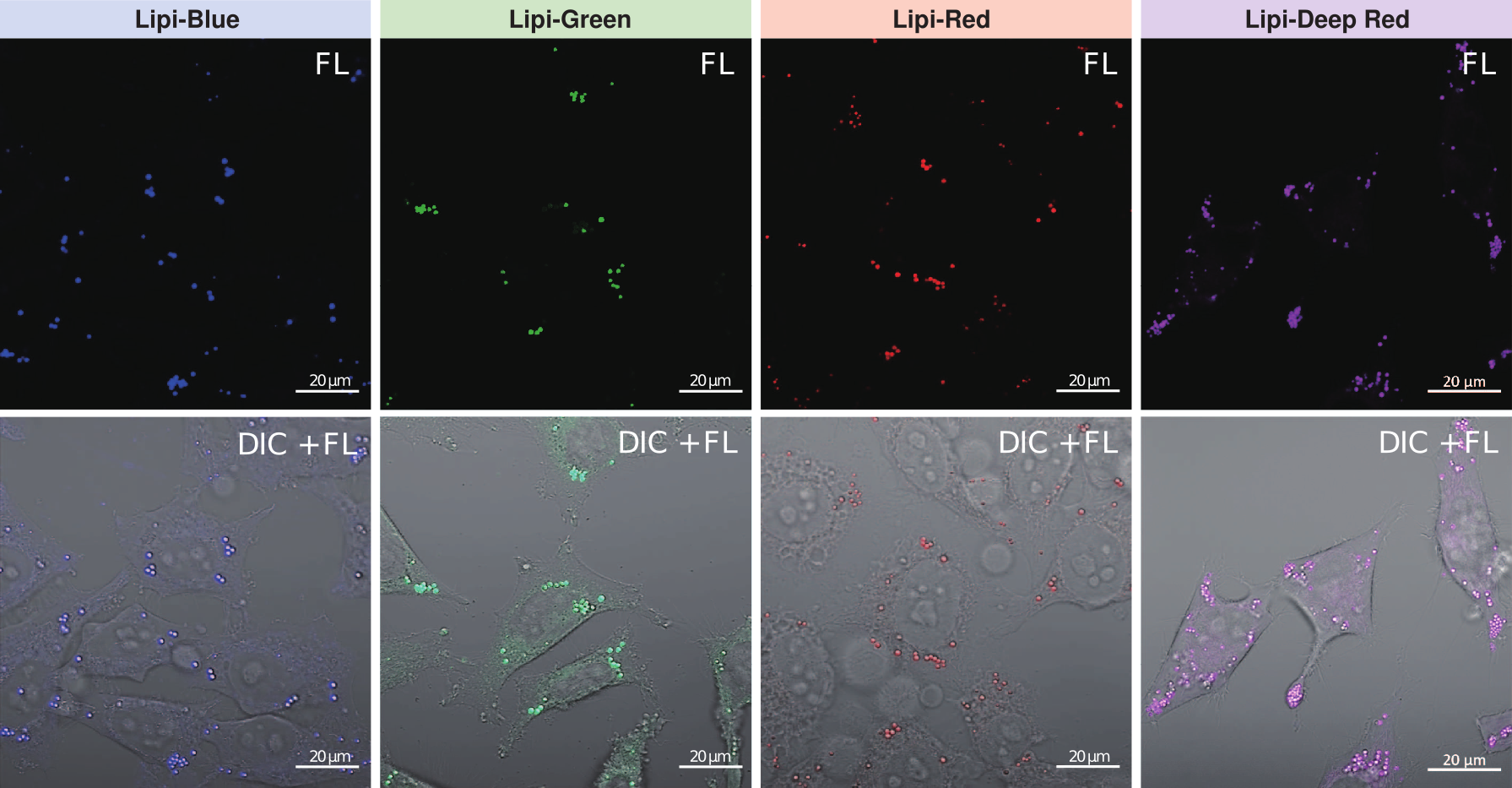
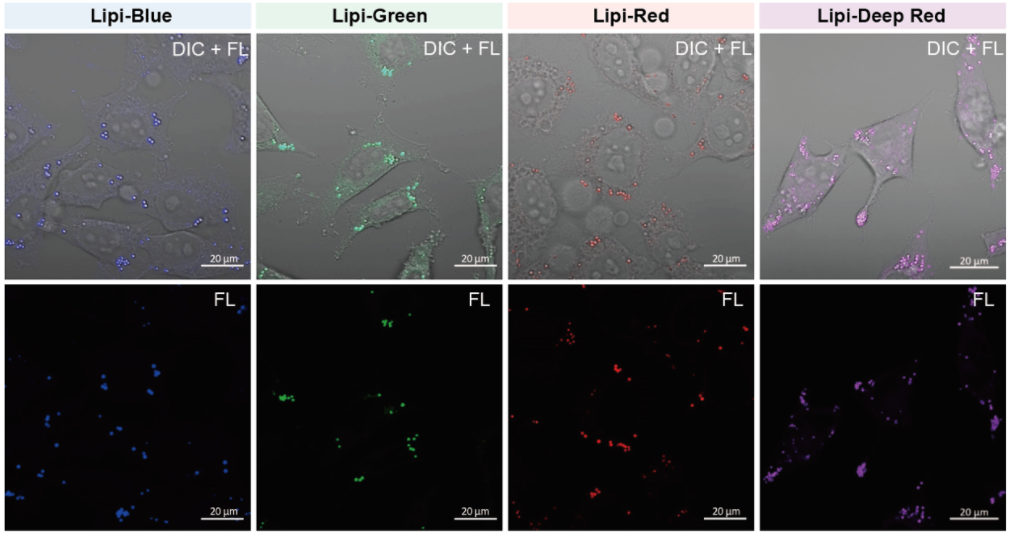
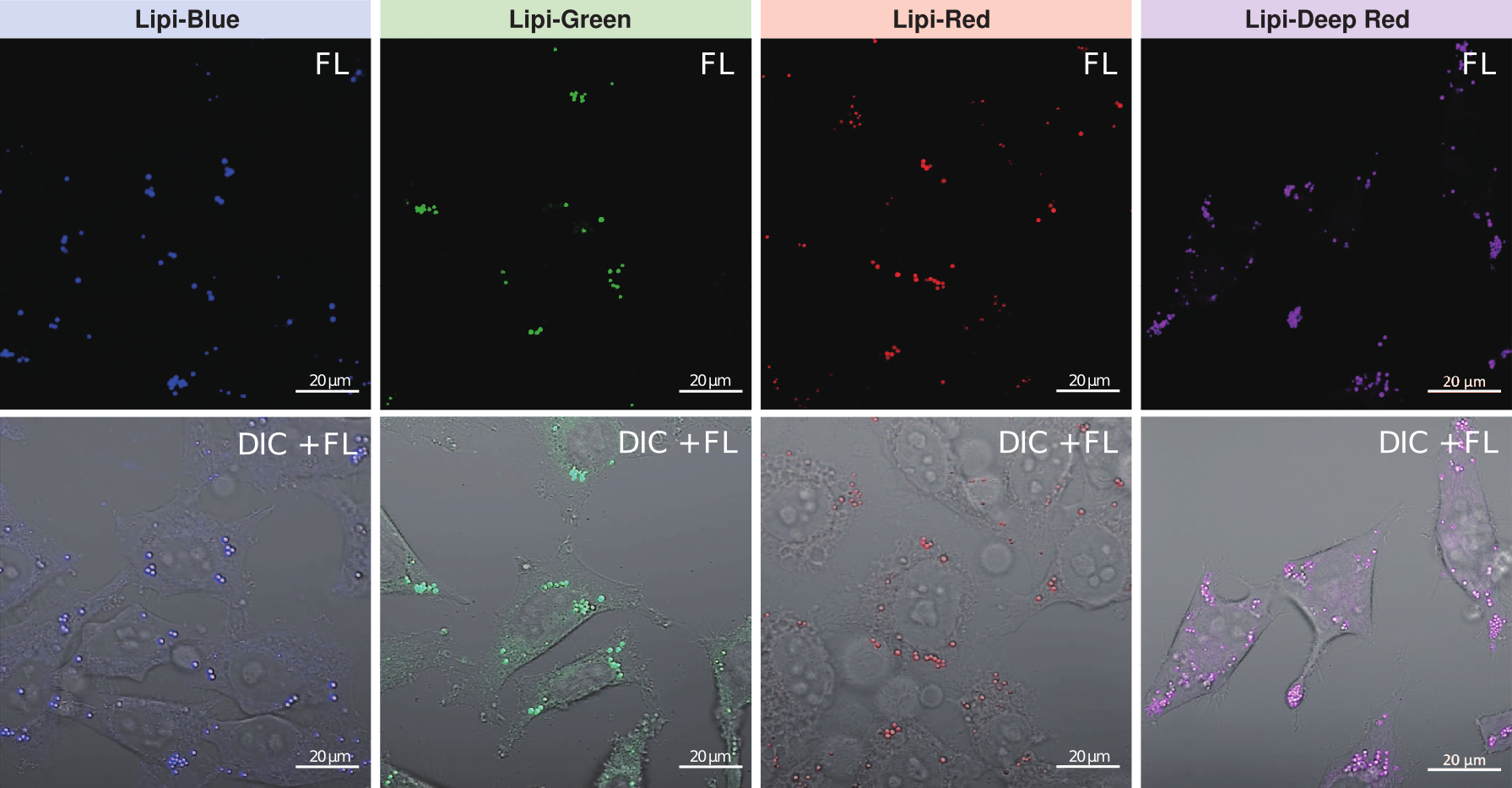
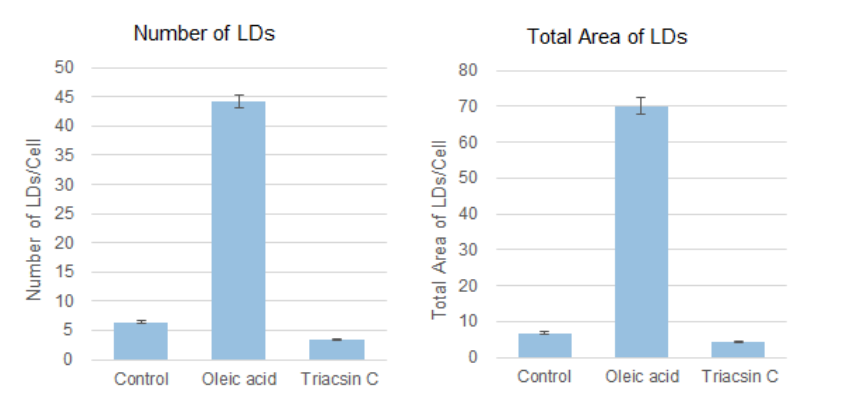
脂滴的染色例
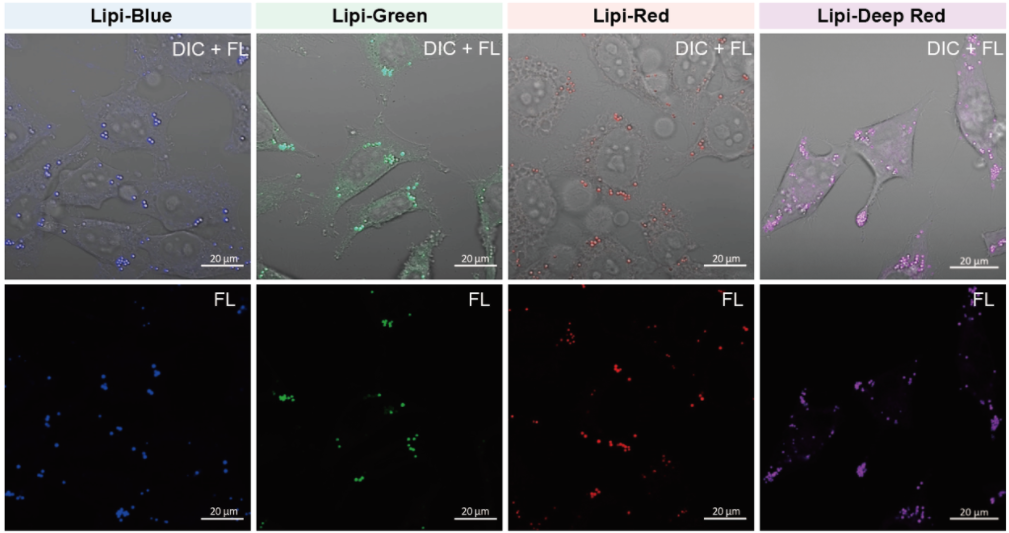
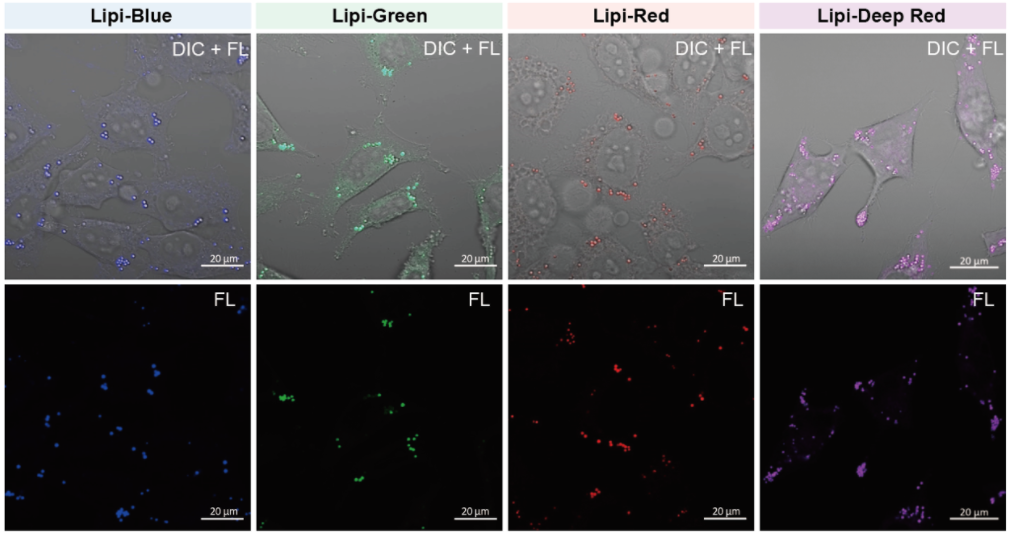
在活细胞状态下,用油酸诱导HeLa细胞后,用不同颜色的Lipi系列荧光探针检测
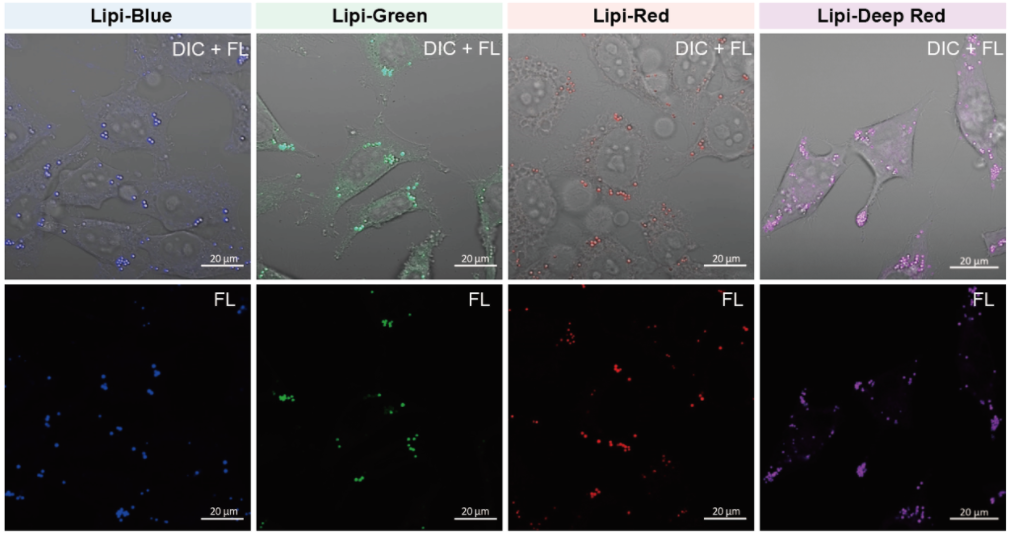
检测条件:
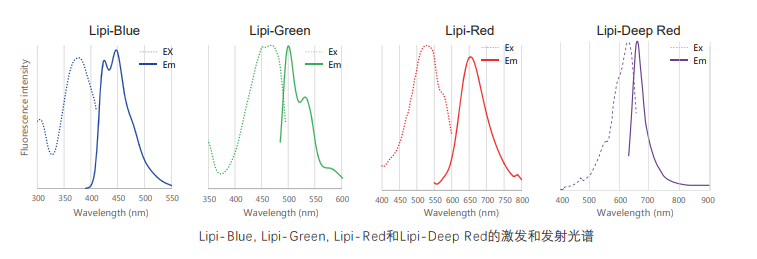
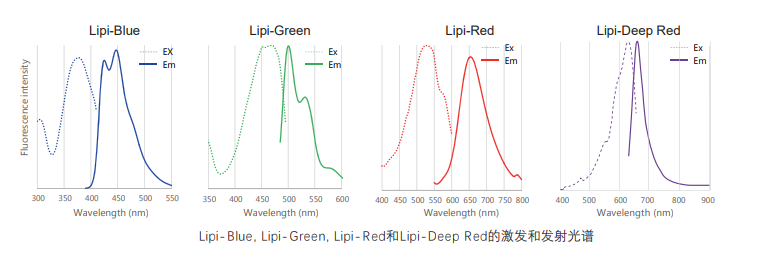
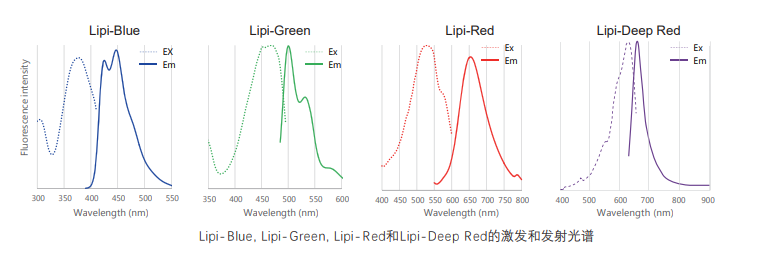
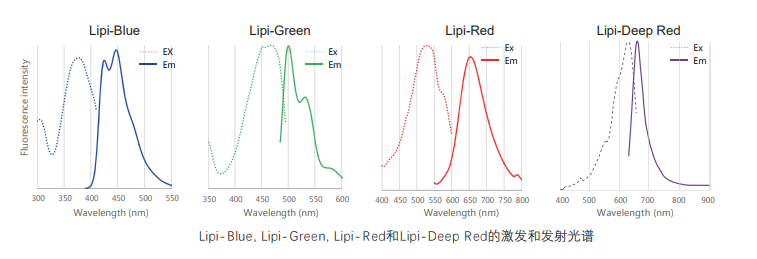
* Lipi-Blue : Ex: 405 nm, Em: 450–500 nm
* Lipi-Green: Ex: 488 nm, Em:500–550 nm
* Lipi-Red: Ex: 561 nm, Em: 565–650 nm
* Lipi-Deep Red: Ex: 640 nm, Em: 650–700 nm
染色条件:
在HeLa细胞培养基中加入200 μmol/l油酸,过夜培养后,用PBS清洗细胞,并分别加入不同颜色的Lipi探针(Lipi-Blue/Green/Deep Red:0.1 μmol/l、Lipi-Red:1 μmol/l) 染色15 min后观察。
如何制备油酸溶液
请参考Q&A“油酸溶液的制备和加入细胞的方法”。
与竞争品比较
Lipi系列荧光探针大幅度地改善了现有脂滴染色试剂存在的问题 (如选择性,滤波器的适应性,荧光滞留性)。而且 Lipi系列荧光探针也适用于多重染色实验,可选颜色更多。
| 同仁化学试剂 | 其他品牌(T公司) | ||||||
| Lipi-Blue | Lipi-Green | Lipi-Red | Lipi-Deep Red | Oil Red O
(比色) |
Nile Red | 试剂B | |
| 活细胞染色 | 〇 | 〇 | 〇 | 〇 | × | 〇 | 〇 |
| 固定细胞染色 | 〇 | 〇 | 〇 | 〇 | 〇 | 〇 | 〇 |
| 对脂肪滴的选择性 (低背景) |
〇 | 〇 | 〇 | 〇 | × | × | △ |
| 与其他试剂的共染色*1 | 〇 | 〇 | 〇*2 | 〇 | n.d. | ×*3 | 〇 |
| 活细胞内的滞留性(24h) | 〇 | 〇 | × | × | n.d. | × | × |
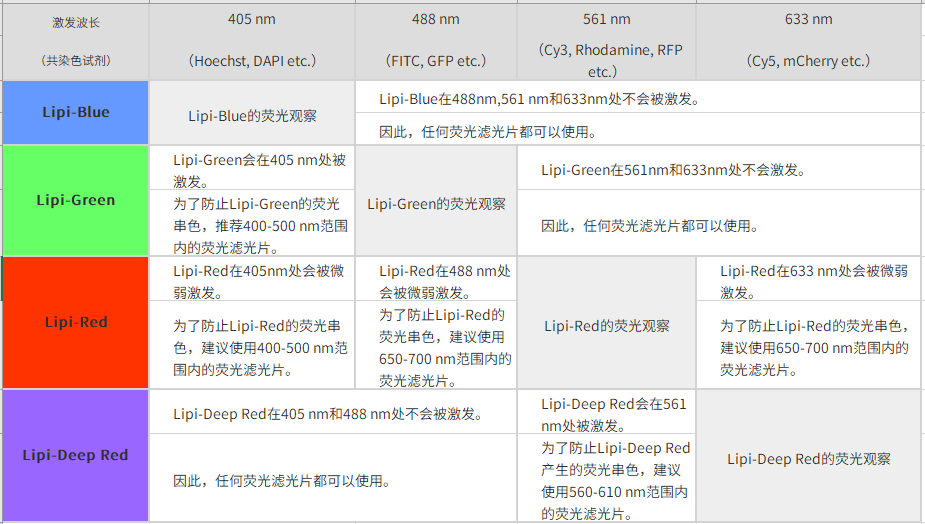
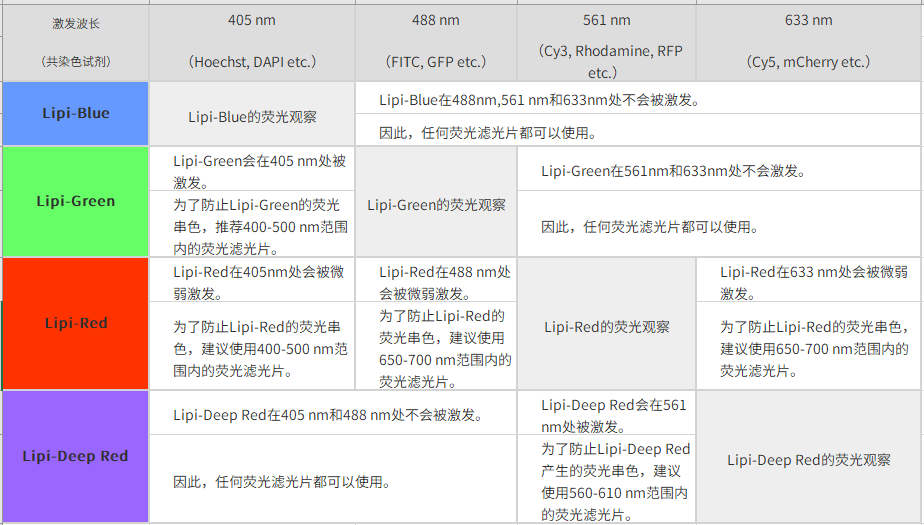
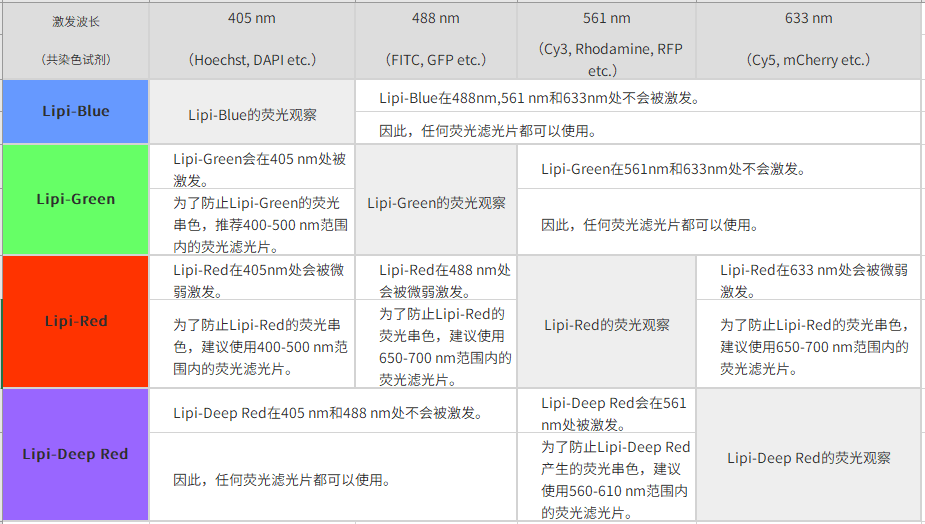
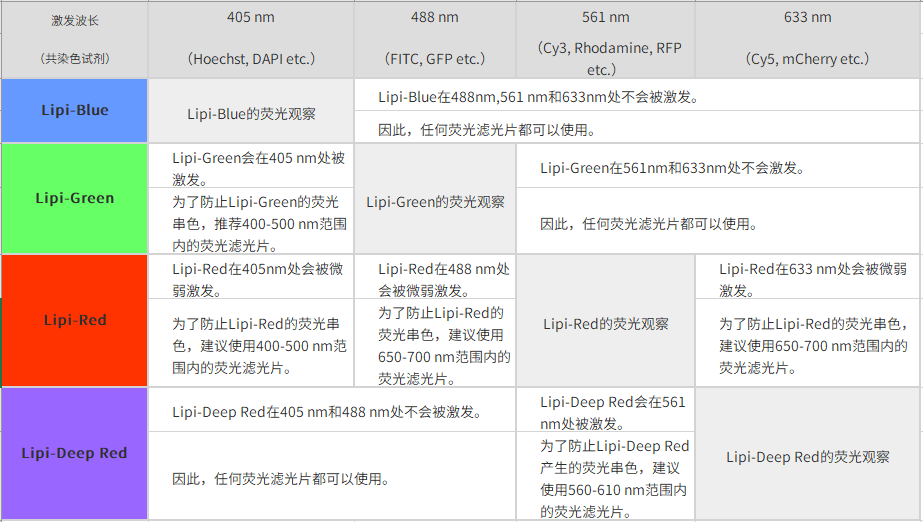
*1. 与绿色荧光共染时,推荐使用550 nm以下的绿色荧光滤光片。
*2. 关于共染时推荐的荧光滤光片,您可以参考网页下方Q&A“共染时推荐的荧光滤光片”。
*3. 用GFP的滤光片(500~540 nm)时会串色。
产品特点
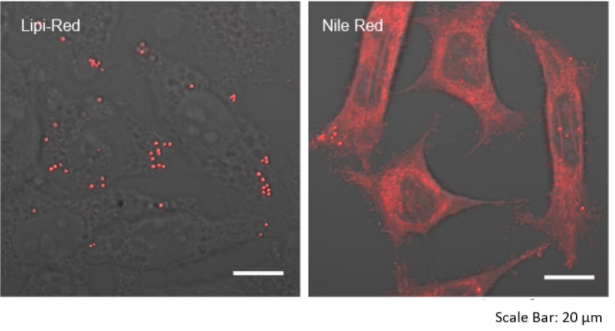
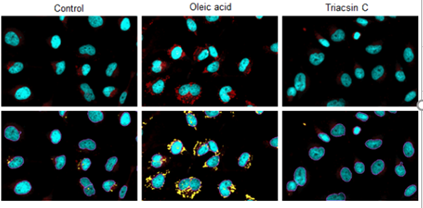
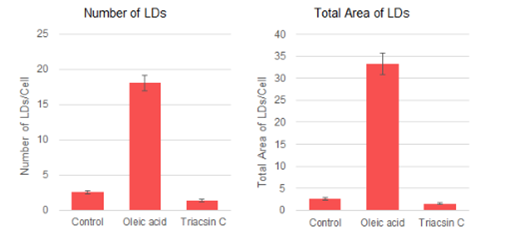
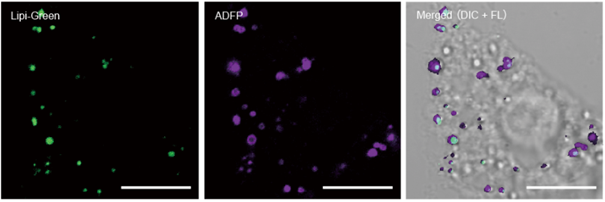
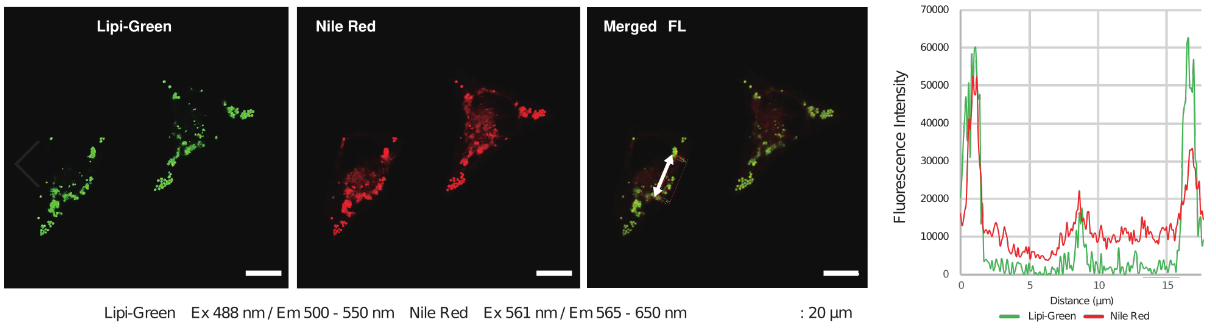
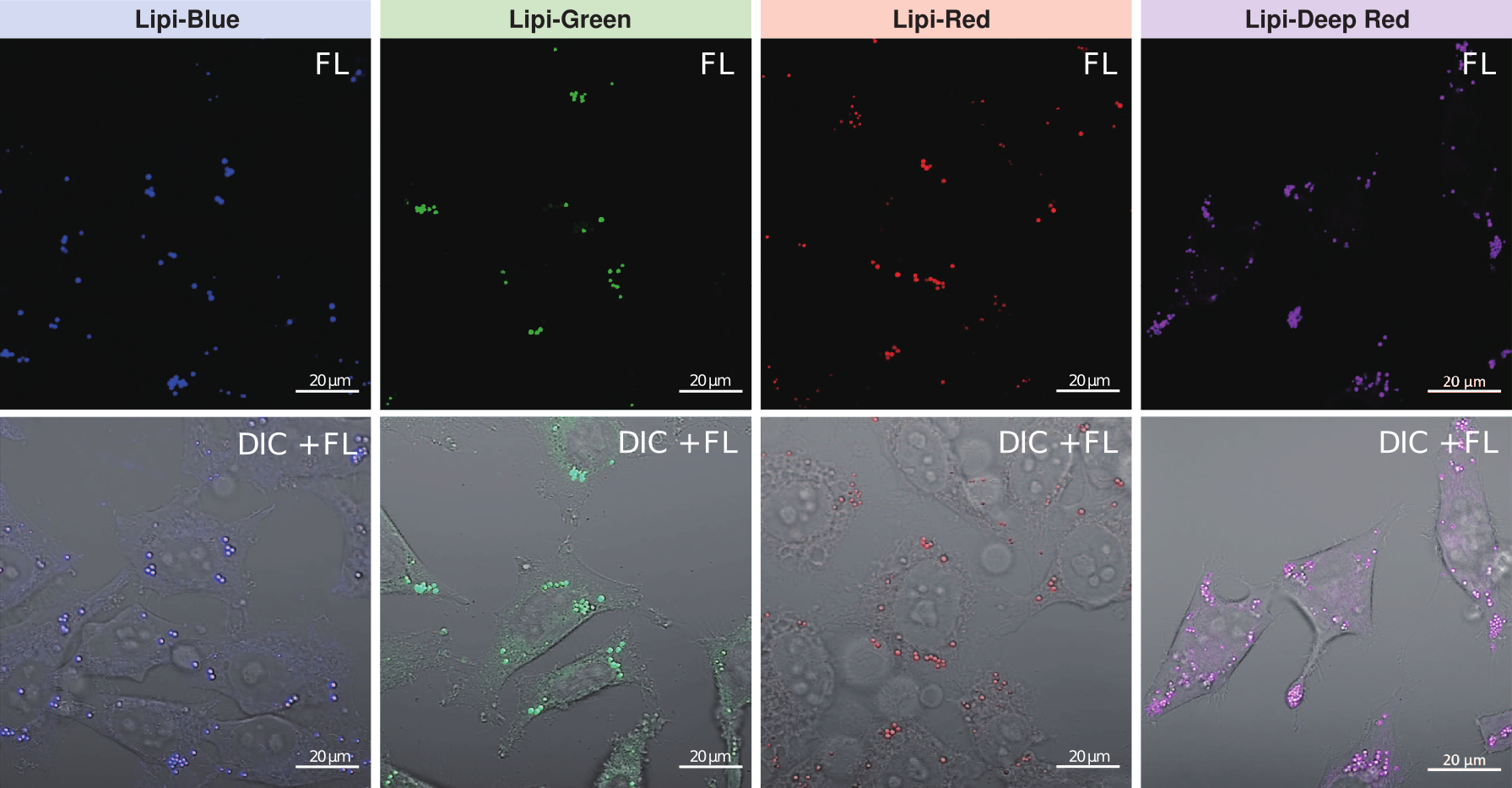
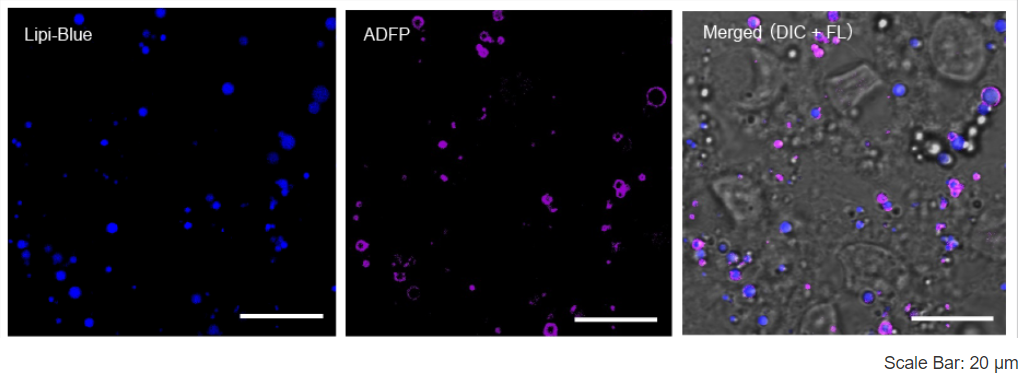
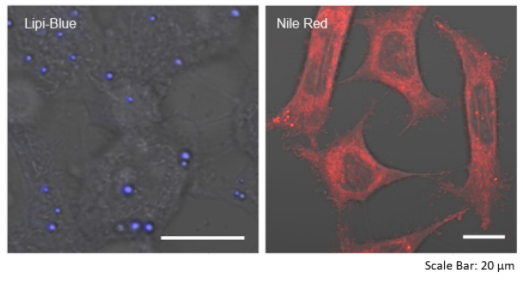
特点1:高特异性定位脂滴
在HeLa活细胞中加入油酸,并用100 nmol/l Lipi-Deep Red 和100 nmol/l Nile Red(T公司)染色。结果显示Nile Red会染上脂滴以外的其它细胞质。
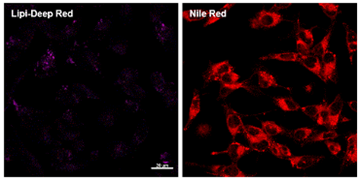
<检测条件>
Lipi-Deep Red: Ex: 640 nm / Em: 650 – 700 nm
Nile Red: Ex: 561 nm / Em: 565 – 650 nm
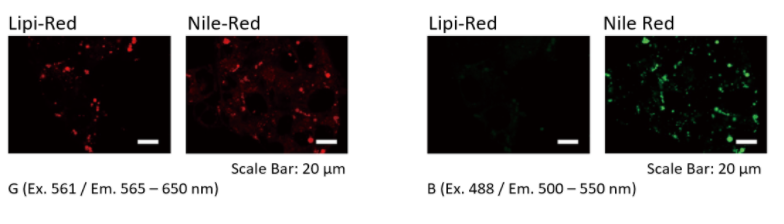
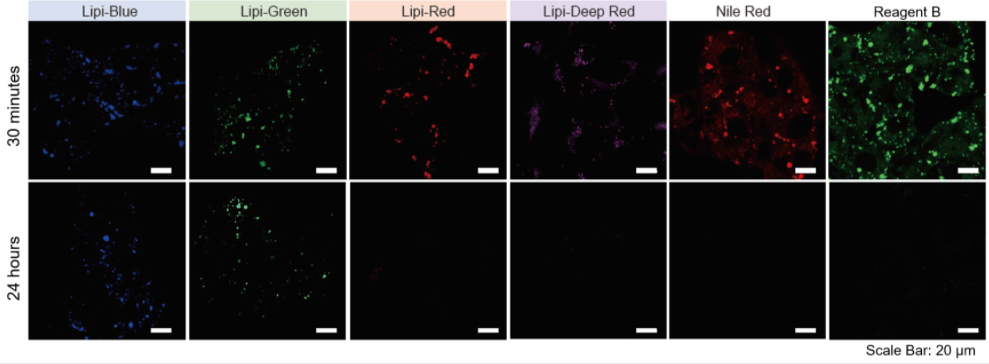
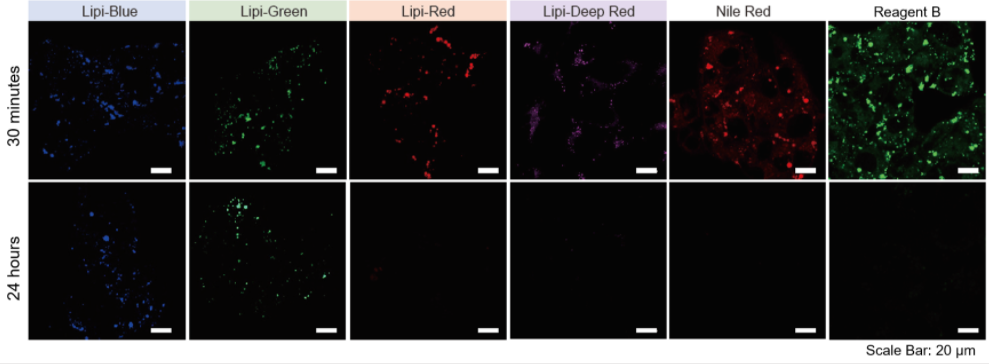
特点2:荧光在细胞中的滞留时间长
分别用Lipi系列、Nile Red和市售的试剂B染色HepG2细胞,观察在培养30 min和24 h时的荧光图像。
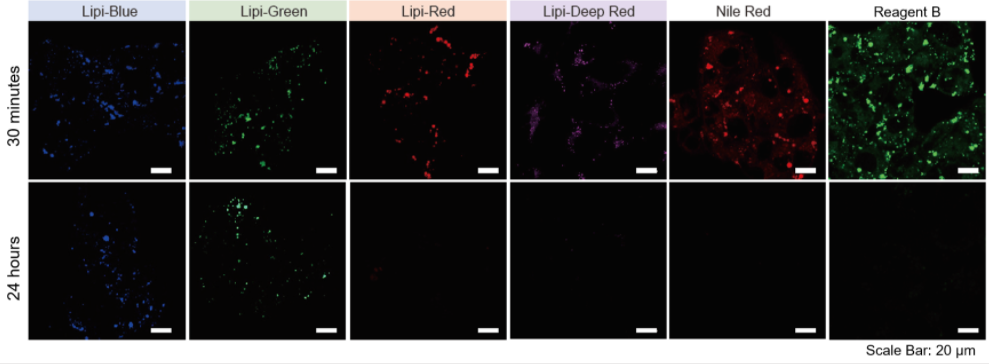
实验证实Lipi-Blue和Lipi-Green在培养24 h后虽然荧光强度有所降低,但仍有荧光。 而Lipi-Red,Lipi-Deep Red,Nile Red和市售试剂B在 培养24 h后几乎无荧光,不适合长时间的实时成像观察。
实验例
实验例1:脂肪细胞的脂滴成像
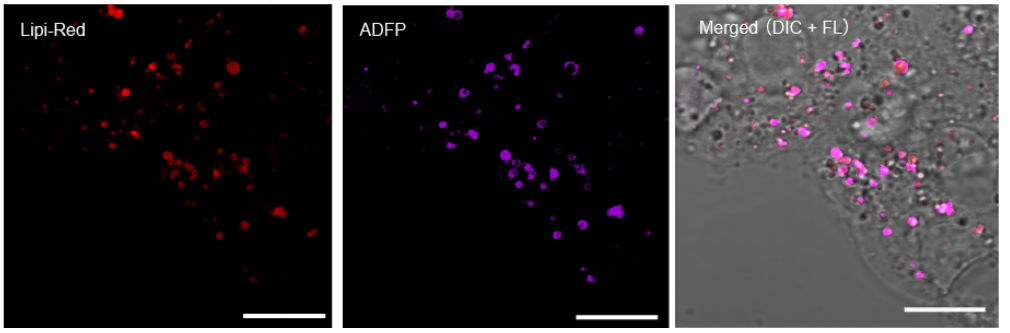
用Lipi系列染色3T3-L1前脂肪细胞,可以清楚地检测出脂肪细胞中的脂质。

<脂肪细胞染色实验例>
(1)将3T3-L1细胞(1.5×104cells/孔)接种在µ-Plate 96孔板(ibidi)的各孔中,并在37℃ 5% CO2培养箱内培养。
(2)按照常规方法诱导分化为脂肪细胞。
(3) 去除上清液,用DMEM(25 mmol/l葡萄糖, 10% FBS, 无酚红)洗涤两次。
(4)加入用DMEM(25 mmol/l葡萄糖,10%FBS,无酚红)制备的每种染料的工作溶液,并在37℃下培养24 h。
(5)用荧光显微镜观察。
※试剂浓度:各2.5 µmol/l
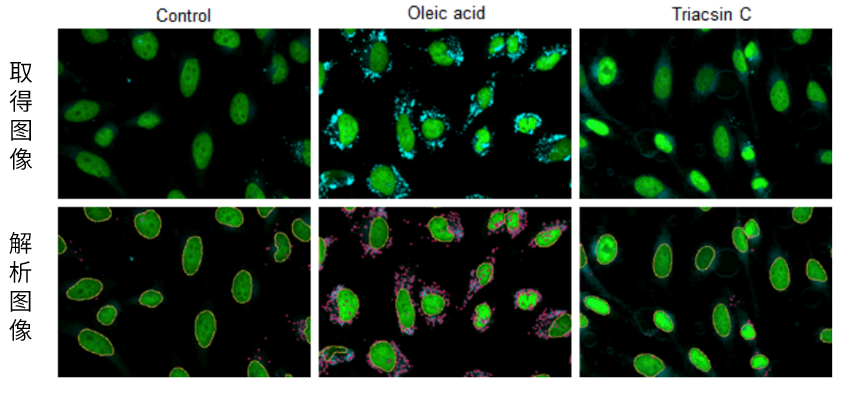
实验例2:脂肪组织的脂滴成像
用4%PFA固定小鼠肝脏脂肪组织(冰冻切片)后用Lipi系列染色,比较幼鼠(6周龄)和老年小鼠(31周龄)的脂滴成像图像,发现肝脏脂肪组织中的脂滴量有很大差异。
<组织样品的染色实验例>
(1)向小鼠肝脏脂肪组织(冰冻切片)中加入4%PFA(PBS),在室温下静置5 min。
(2)用PBS清洗后,加入各浓度的Lipi系列working solution(PBS),在4℃下静置24 h。
(3)用PBS清洗后,用落射型荧光显微镜进行荧光观察。
※工作液浓度:2.5 µmol/l(Lipi-Blue、Lipi-Green、Lipi-Deep Red)、25 µmol/l(Lipi-Red)
Lipi系列荧光图谱
脂肪滴产品种类的检测方法
| 产品名称 | 规格 | 货号 | |||
| 成像(成像)
脂滴荧光探针 |
Lipi-Blue | 10 nmol | LD01 | ||
| Lipi-Green | 10 nmol | LD02 | |||
| Lipi-Red | 100 nmol | LD03 | |||
| Lipi-Deep Red | 10 nmol | LD04 | |||
| 定量(荧光酶标仪,FCM) 脂滴荧光检测试剂盒 |
Lipid Droplet Assay Kit – Blue | 1 set | LD05 | ||
| Lipid Droplet Assay Kit – Deep Red | 1 set | LD06 | |||
常见问题Q&A
| Q1:油酸溶液的制备和加入细胞的方法 |
| A1:我们按照以下步骤制备和使用油酸溶液。 <油酸储存溶液> 必要的试剂 ·BSA(牛血清白蛋白) ·油酸 ·0.1 mol/l Tris-HCl(pH8.0) 制备步骤 1)在0.1 mol/l Tris-HCl(pH8.0)中加入BSA并溶解(BSA:浓度0.14 g/ml)。 2)在容器(一次性的离心管)中加入油酸后,加入步骤1)得到的BSA溶液,使用涡旋振荡器进行混合(油酸浓度:4 mmol/l)。*1 3)用孔径为0.22 µm的注射式过滤器(PTFE)过滤步骤2)的混合溶液。 4)每次使用后冷藏保存。*2 * 1 油酸和BSA溶液混合可能导致液体混浊,继续摇动让油酸和BSA形成复合物使混浊会消失。 * 2 将所需量的油酸储备溶液加入到实验使用的培养基中,用于将油酸加入到细胞中。 <加入细胞的方法> 1)将细胞在37℃ 5%CO2培养箱内培养24 h。 2)用加入了油酸储备溶液的培养基(油酸的终浓度200 µmol/L)替换,再培养24 h。 3)然后按照说明书对脂滴进行荧光染色观察。 |
| Q2:共染时推荐的荧光滤光片。 |
|
| Q3:检测不到荧光信号的应对方法是什么? |
| Q4如果没有检测到荧光信号,可能会有几个因素。 请确认以下内容,并根据情况考虑优化条件。 1.激发·发射波长与染料的荧光特性不一致。 确认说明书上的荧光图谱和您仪器的激发和发射波长是否匹配。 2.染色条件不是最合适的。 [试剂浓度] 确认工作液的浓度是否在以下范围内。 Lipi-Blue,Lipi-Green:0.1-0.5μmol/l Lipi-Red:1-5μmol/l *如果在上述条件下仍未检测到荧光信号,请提高染色浓度。 Lipi-Blue,Lipi-Green:1-2μmol/l Lipi-Red:10-20μmol/l [染色时间] -一般是30min,如没有荧光信号可以延长染色时间至1-2 h。 3.固定条件不适合。 根据细胞种类不同,染色前后的固定操作可能会导致无法染色或灵敏度减弱。 在这种情况下,“请参考Q&A:是否可以对固定细胞进行染色?。 4.脂滴小,难以确认。 根据细胞的不同,可能会有脂滴很小难以确认的情况。 这种情况下,我们建议在高倍率的显微镜下确认,或用油酸处理细胞作为阳性对照进行评估。 |
| Q4:是否可以对固定细胞进行染色? |
| A4:可以染色,固定细胞的染色步骤有以下注意事项: ※请用多聚甲醛 (PFA) 固定细胞,不建议用甲醇等醇类固定细胞,因为可能会影响脂滴的结构。 ※部分细胞种类染色后,如果在固定细胞过程中出现无染色或染色强度不够的情况,需要摸索最佳固定条件。 ○细胞染色后固定实验例 (以HepG2细胞为例) 1. 将HepG2细胞接种在µ-Slide 8孔板上,并在37℃ 5% CO2培养箱中过夜培养。 2. 去除培养基,用PBS清洗2次。 3. 在细胞中加入用PBS配制的Lipi工作液,在37℃培养箱中培养15 min。 4. 去除上清液,用PBS清洗2次。 5. 加入4% PFA (在PBS中),在室温固定5 min。 6. 去除上清液,用PBS清洗后,在荧光显微镜下观察。 ○细胞染色前固定实验例 (以HeLa细胞为例) 1. 将HeLa细胞接种在µ-Slide 8孔板上,并在37℃ 5% CO2培养箱中过夜培养。 2. 去除培养基,用PBS清洗2次。 3. 加入4% PFA (在PBS中),在室温固定5 min。 4. 去除上清液,用PBS清洗2次。 5. 在细胞中加入用PBS配制的Lipi工作液,在37℃培养箱中培养30 min。 6. 去除上清液,用PBS清洗后,在荧光显微镜下观察。 |
关联产品














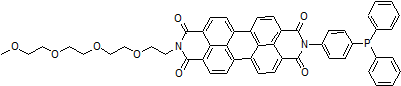

 Lipi-Green
Lipi-Green