上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 Fatty Acid Uptake Assay Kit
Fatty Acid Uptake Assay Kit
01 細胞増殖/細胞毒性測定用試薬
Fatty Acid Uptake Assay Kit
- 細胞増殖/細胞毒性測定用試薬
- 細胞機能解析
- 細胞内代謝
- 顕微鏡
- FCM
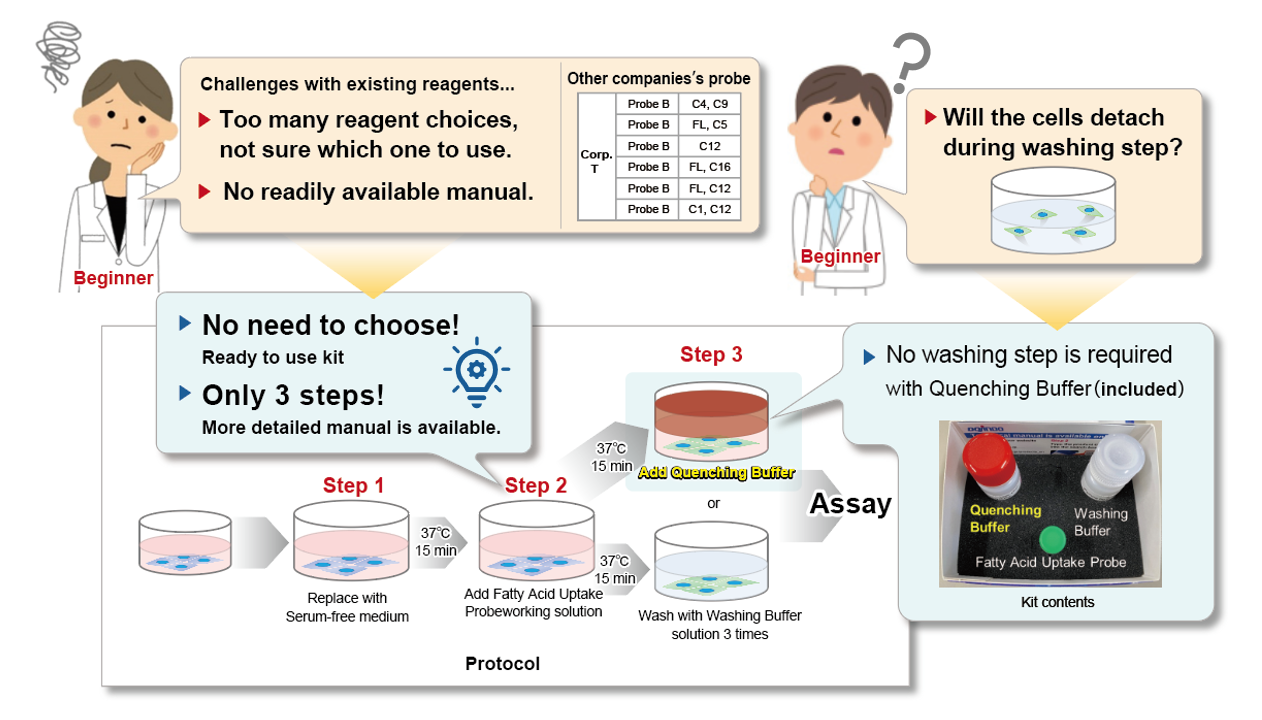
脂肪酸取り込み検出キット
- 脂肪酸取り込み能力を高感度かつ簡便に測定できる
- 3 ステップの簡便操作
- Quenching Buffer(同梱)で洗浄不要
| 容 量 |
メーカー希望
小売価格 |
富士フイルム
和光純薬 |
| 100 tests |
¥32,000 |
343-10031 |
使用回数の目安
1 set あたり96-well plate 1 枚
キット内容
| 100 tests |
・Fatty Acid Uptake Probe
・Quenching Buffer
・Washing Buffer (10X) |
×1
11 ml×1
11 ml×1 |
技術情報
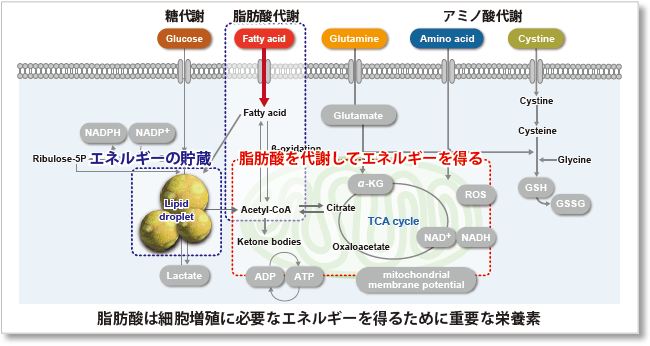
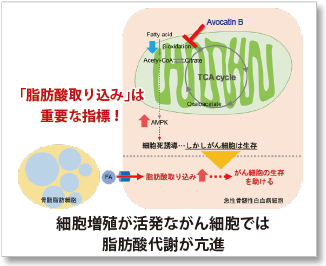
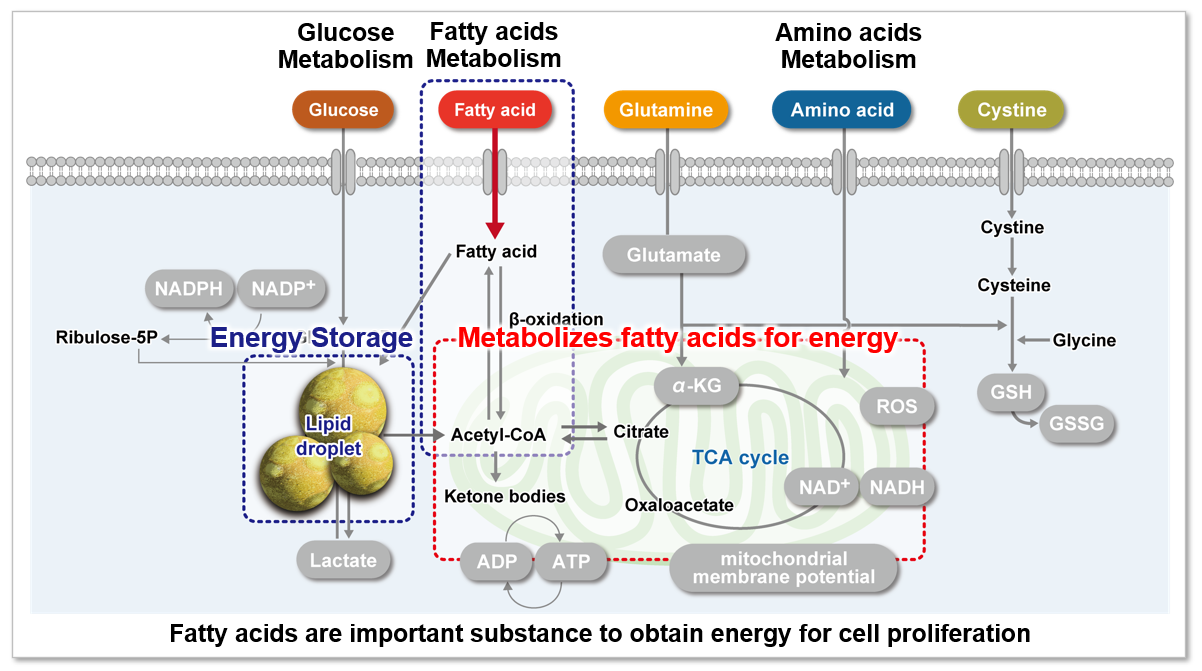
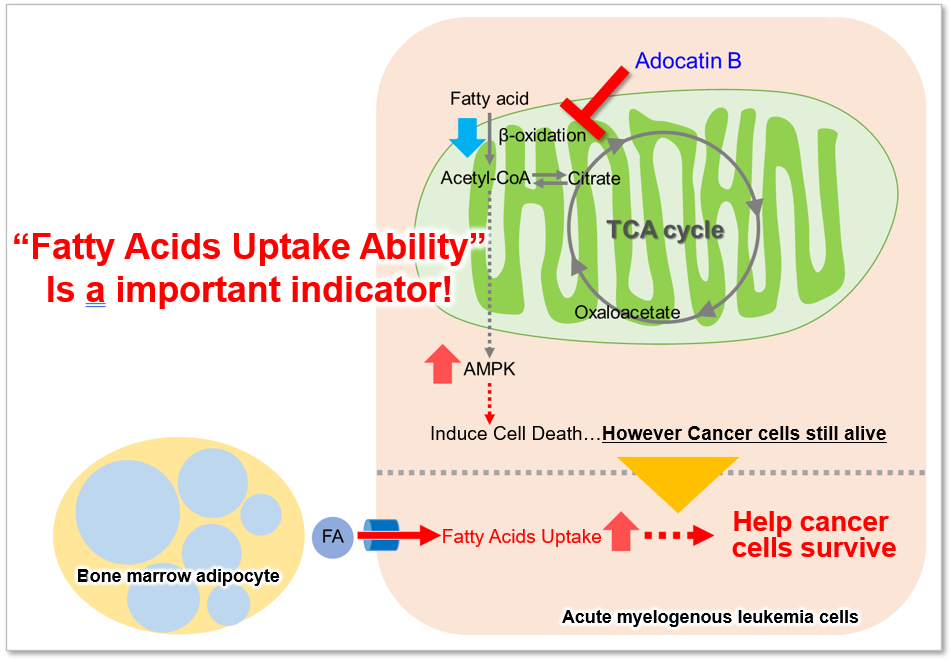
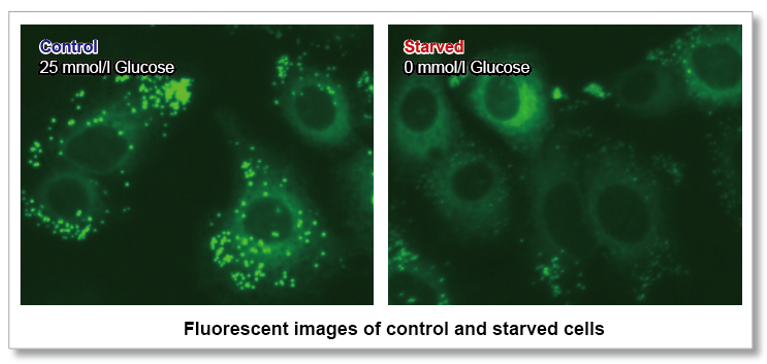
なぜ、脂肪酸取り込み能力が注目されているのか?
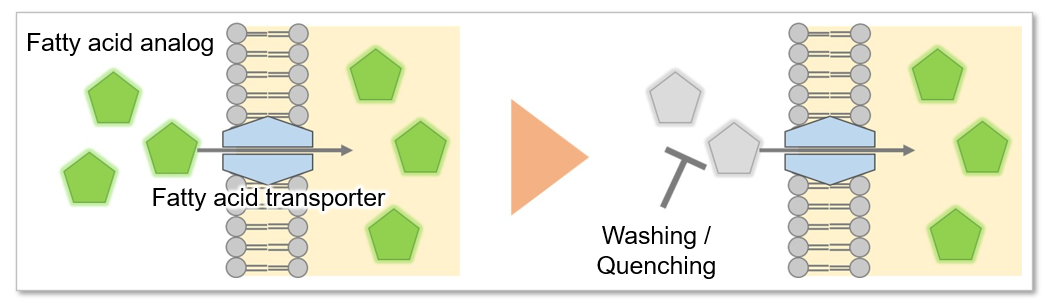
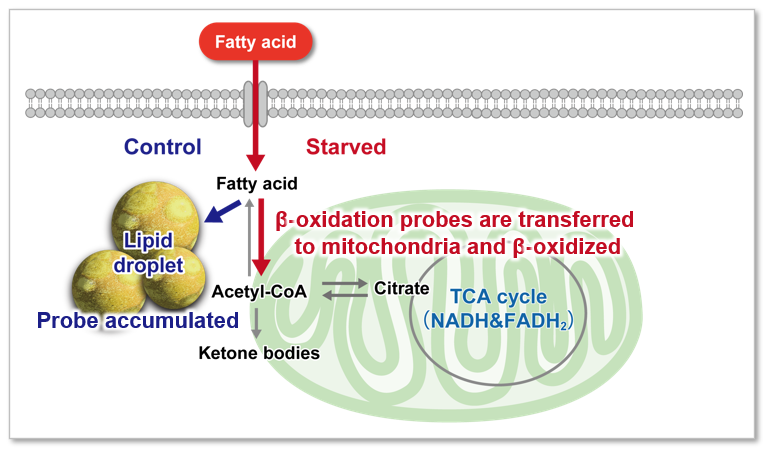
脂肪酸は、生体がエネルギーを得るために重要な物質です。脂肪酸取り込み能は肥満や糖尿病などの疾患に関わるだけでなく、がん細胞における代謝指標の 1 つでもあります(左図)。細胞増殖が活発ながん細胞は多くの脂質を必要とするため、細胞内における脂肪酸合成や細胞外からの脂肪酸取り込みが活発に行われています(右図)。そのため、がん細胞の脂肪酸代謝経路をターゲットとした多くの薬剤が開発されています。
よくある質問
-
Q
-
A
下記の細胞において使用実績がございます。
| 細胞名 |
由来 |
|
A549
|
ヒト肺胞基底上皮腺癌細胞
|
|
HepG2
|
ヒト肝癌由来細胞
|
|
HeLa
|
ヒト子宮頸癌由来細胞
|
|
Jurkat
|
ヒト白血病T細胞
|
|
MOLT-4
|
ヒト急性リンパ芽球性白血病細胞
|
|
3T3-L1 (preadipocyte)
|
前駆脂肪細胞
|
|
3T3-L1 (adipocyte)
|
脂肪細胞
|
-
Q
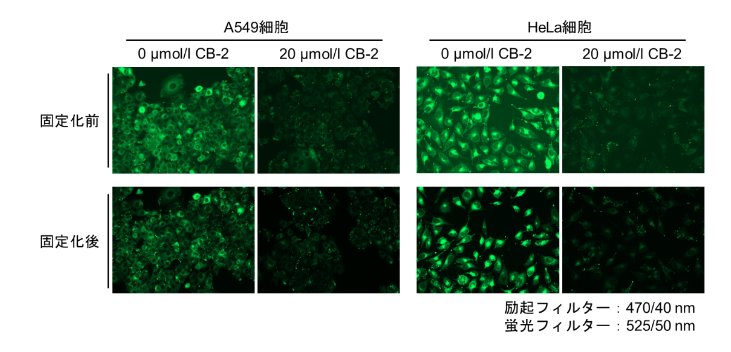
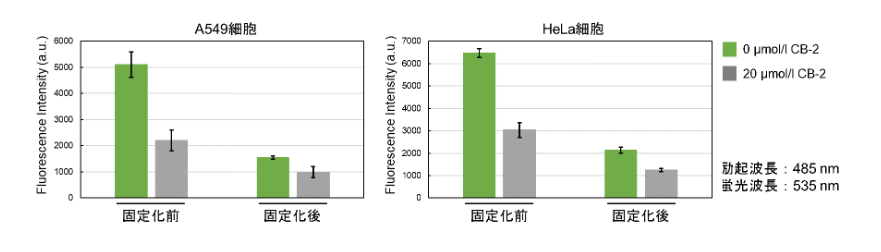
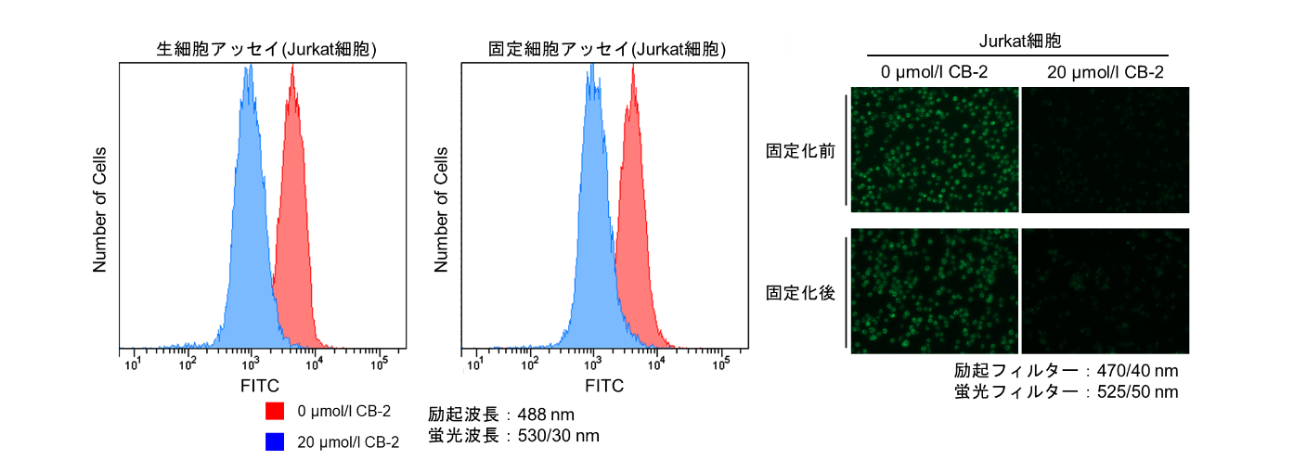
Fatty Acid Uptake Probeを生細胞へ取り込ませた後、細胞を固定することは可能でしょうか?
-
A
4% PFAを用いて染色後の細胞を固定した実績がございます。
〈プロトコル〉
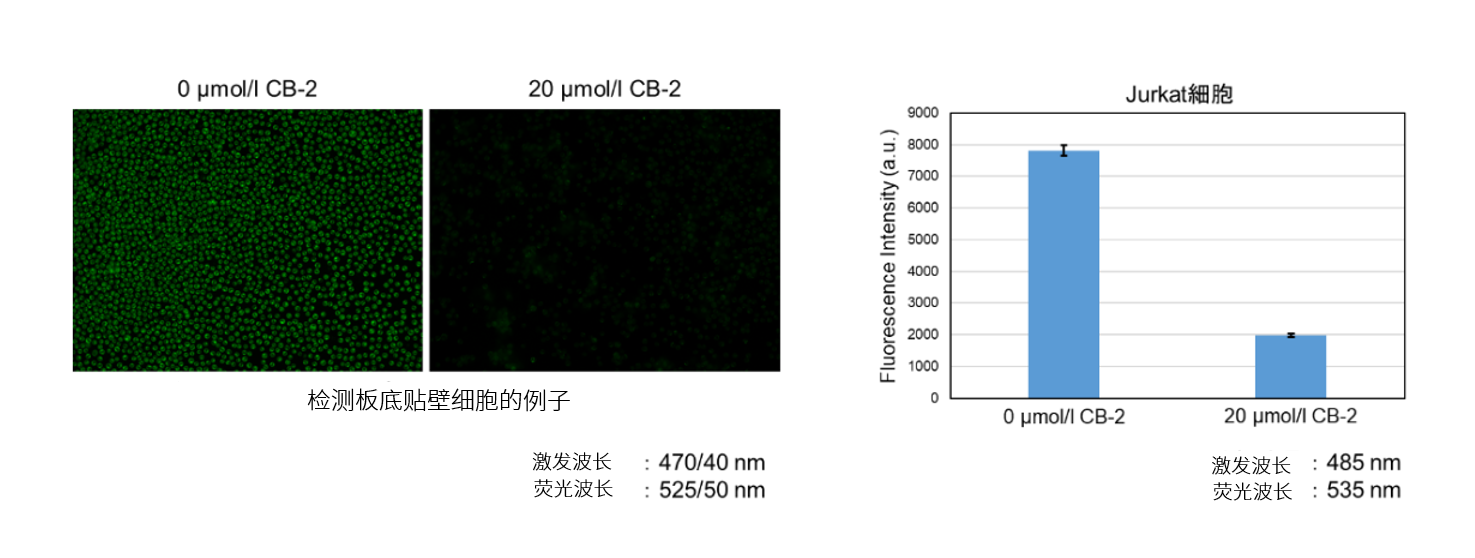
-付着細胞-
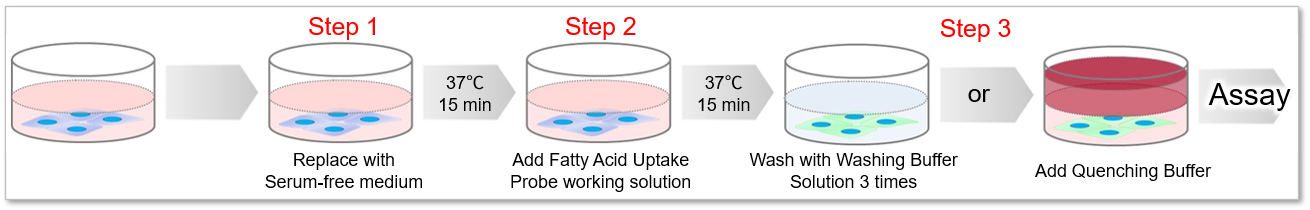
1. ディッシュまたはマイクロプレートに播種した細胞を準備した。
2. 培地を除去し、無血清培地で2回洗浄した。
3. 無血清培地を添加し、インキュベーター(37℃、5%CO2存在下)で15分間静置した。
4. 上清を除去した後、Fatty Acid Uptake Probe working solutionを添加し、インキュベーター(37℃、5%CO2存在下)で15分間静置した。
5. 上清を除去した後、Washing Buffer solutionで1回洗浄した。
6. 4% PFA/PBSを細胞へ添加し、室温で5分間インキュベートした。
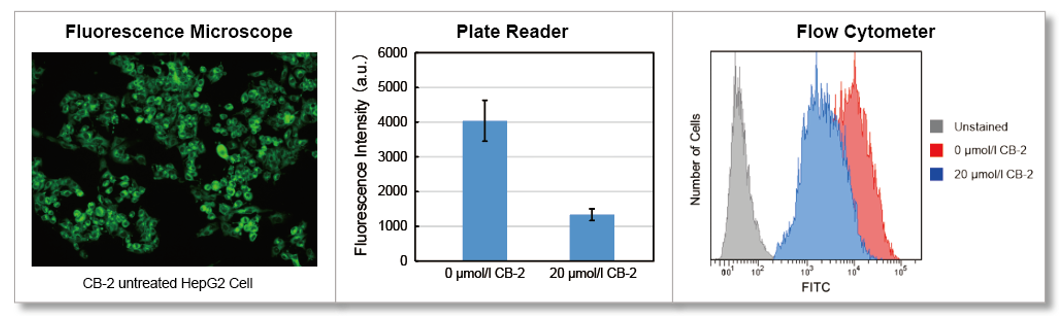
7. PBSで細胞を3回洗浄後、蛍光顕微鏡で観察、プレートリーダーで測定した。
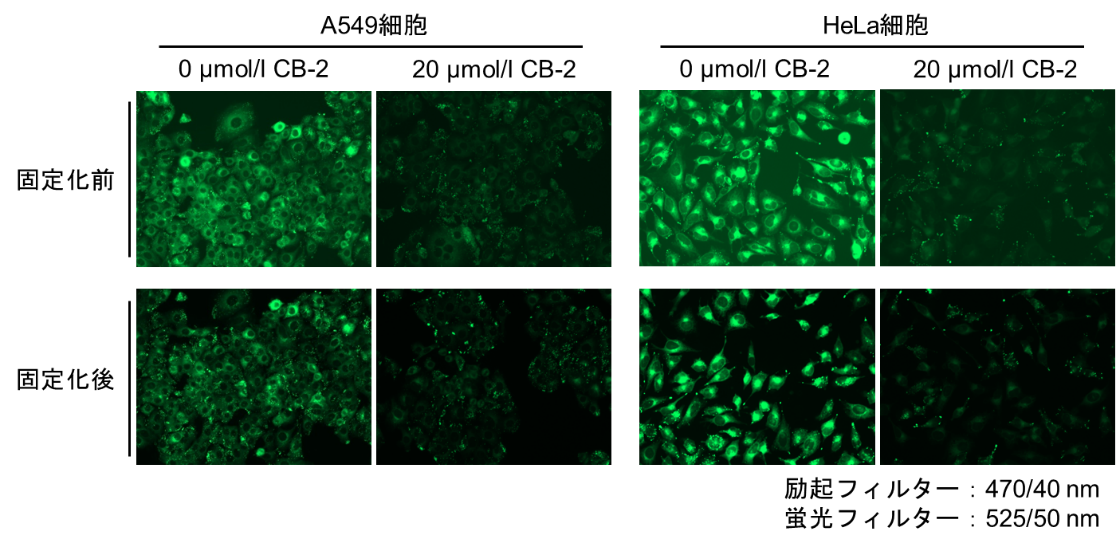
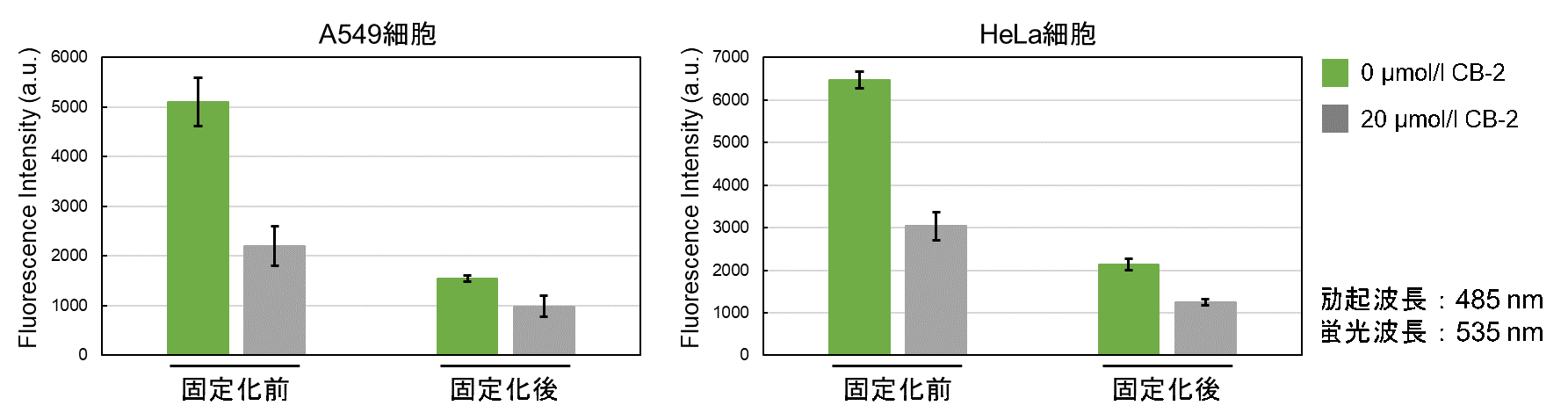
※固定化により蛍光強度は低下します。
-浮遊細胞-
1. マイクロチューブに細胞を準備した。
2. 300×gで5分間遠心し、上清を除去した。
3. 無血清培地を加え、ピペッティングにより懸濁後、300×gで5分間遠心し、上清を除去した。この操作を2回繰り返した。
4. 無血清培地を添加し、ピペッティングにより懸濁後、インキュベーター(37℃、5%CO2存在下)で15分間静置した。
5. 300×gで5分間遠心し、上清を除去した。
6. Fatty Acid Uptake Probe working solutionを添加し、ピペッティングにより懸濁後、インキュベーター(37℃、5%CO2存在下)で15分間静置した。
7. 300×gで5分間遠心し、上清を除去した。
8. Washing Buffer solutionで1回洗浄した。
9. 4% PFA/PBSを添加し、ピペッティングにより懸濁後、室温で5分間インキュベートした。
10. 300×gで5分間遠心し、上清を除去した。
11. PBSを加え、ピペッティングにより懸濁後、300×gで5分間遠心し、上清を除去した。この操作を2回繰り返した。
12. 蛍光顕微鏡で観察、フローサイトメーターで測定した。
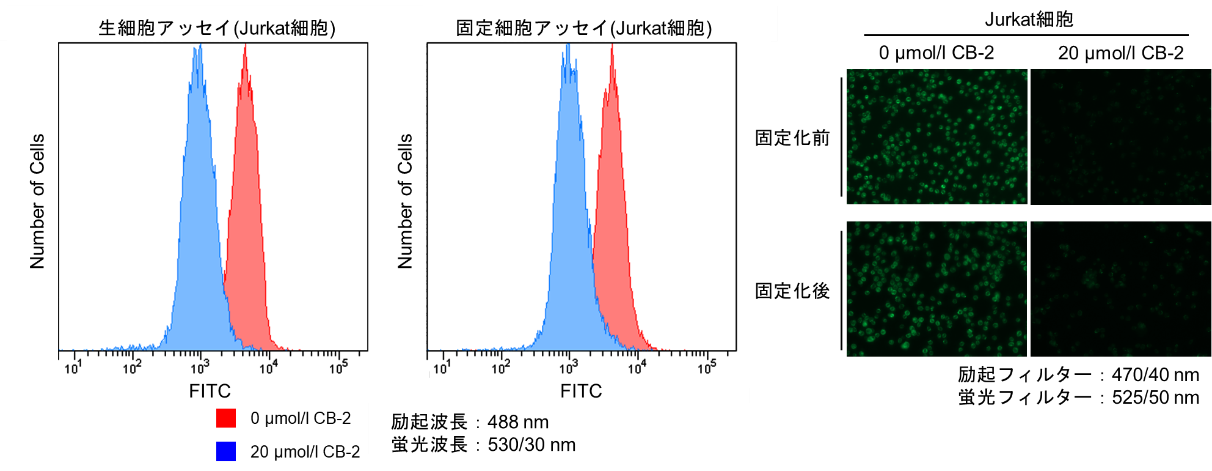
-
Q
プレートリーダーで測定する場合、どのプレートを使用すればよいでしょうか?
-
A
蛍光検出のため細胞培養用のブラックマイクロプレートをご使用ください。
〇: 使用可、×: 使用不可、△: 注釈参照
|
|
付着細胞
|
浮遊細胞
|
|
|
不透明底
プレート
|
透明底
プレート
|
不透明底
プレート
|
透明底
プレート
|
|
Washing Buffer (10×)
使用時
|
Top Reading
|
〇
|
〇
|
|
Bottom Reading
|
×
|
〇
|
×
|
〇
|
|
Quenching Buffer
使用時
|
Top Reading
|
×
|
×
|
|
Bottom Reading
|
×
|
〇
|
×
|
△※
|
※細胞がプレートの底を覆う程度に播種し、しばらく静置させて細胞をプレートの底に沈めることで測定することは可能です。
〈Quenching Buffer使用時、浮遊細胞のデータ〉

また、使用実績のあるマイクロプレートは下記の通りです。
|
メーカー名
|
製品名
|
Cat No.
|
|
ibidi
|
µPlate 96 well ibiTreat black S 15
|
ib89626
|
|
Thermo Fisher
|
96 Well Black/Clear Bottom Plate, TC Surface, Pack of 10
|
165305
|
-
Q
Fatty Acid Uptake Probe working solutionは保存可能でしょうか?
-
A
Fatty Acid Uptake Probe working solutionは保存できません。
-
Q
バックグラウンドが高い場合、どうすればいいですか?
-
A
細胞に取り込まれなかったFatty Acid Uptake Probeがウェル内に残存している可能性があります。Washing Buffer solutionによる洗浄を繰り返すか、Quenching Bufferの使用をご検討ください。
-
Q
1キットあたり測定可能なサンプル数を教えてください。
-
A
下記表をご参照ください。
|
|
付着細胞
|
浮遊細胞
|
|
培養器材
(添加量)
|
6-well
(1.5 ml/well)
|
24-well
(0.3 ml/well)
|
96-well
(0.1 ml/well)
|
35-mm dish
(1.5 ml/well)
|
1.5-ml microtube
(0.5 ml/tube)
|
|
測定可能
サンプル数
|
7 sample
|
34 sample
|
100 sample
|
7 sample
|
20 sample
|
-
Q
Quenching Bufferを使用して共焦点レーザー顕微鏡で透過光観察を行ったのですが、透過光観察ができません。どうすればいいですか?
-
A
Quenching Bufferを使用して共焦点レーザー顕微鏡で透過光観察を行う場合は、QuenchingBufferをWashing Buffer solutionで10倍希釈してご使用いただくか、640 nmレーザーを用いて透過光観察を行ってください。
〈共焦点レーザー顕微鏡で透過光観察を行う場合に見られる現象〉

-
Q
-
A
-
Q
細胞内に取り込まれた色素(Fatty Acid Uptake Probe)を定量することはできますか?
-
A
取り込まれた色素(Fatty Acid Uptake Probe)を定量することはできません。本製品は、脂肪酸取り込み能力の増減を確認するためのキットとなります。
-
Q
-
A
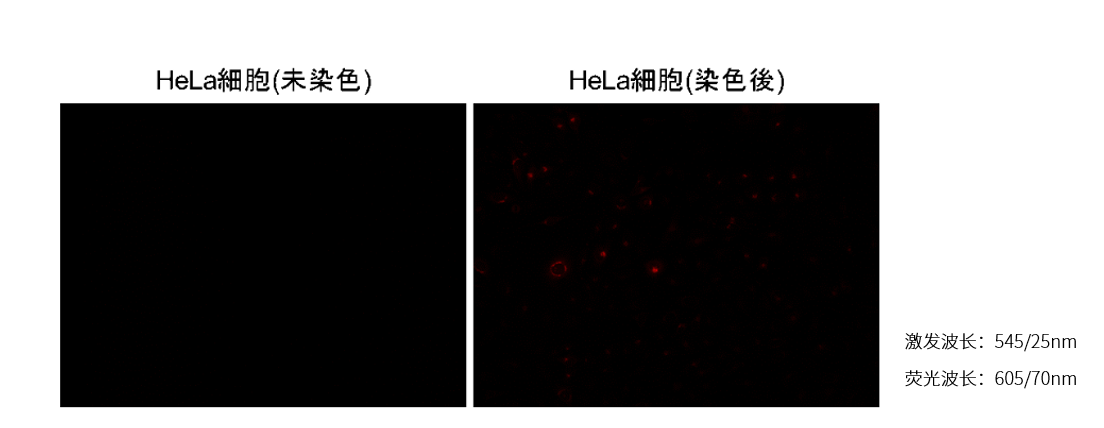
Fatty Acid Uptake Probeは赤色蛍光への漏れ込みが僅かに観察されます。そのため、緑色および赤色蛍光検出以外の色素を用いて共染色を行って下さい。
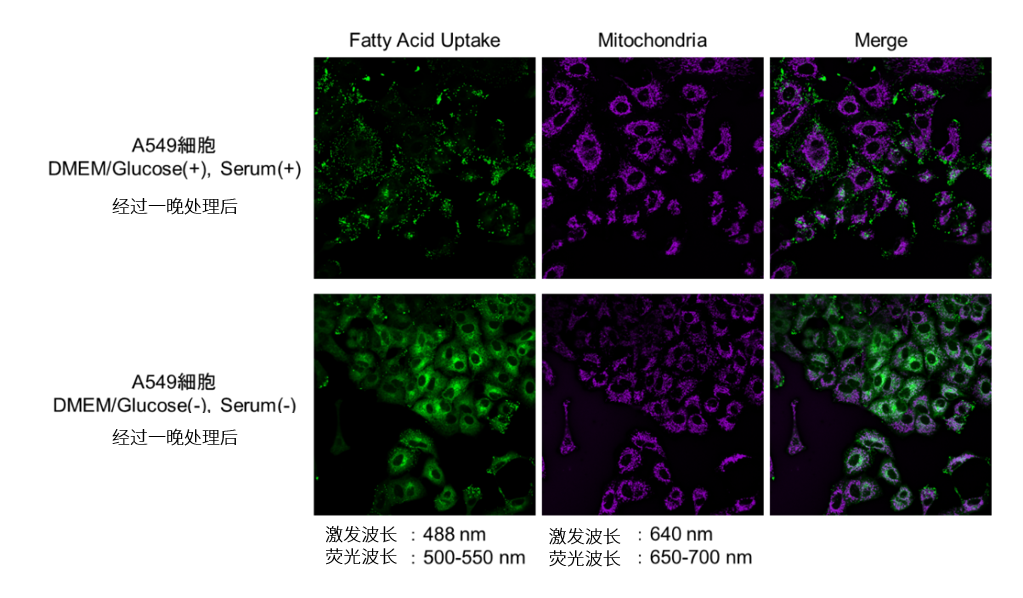
弊社ミトコンドリア染色用色素MitoBright LT Deep Red (MT12)との共染色を行った実績がございます。
〈赤色蛍光への漏れ込み〉
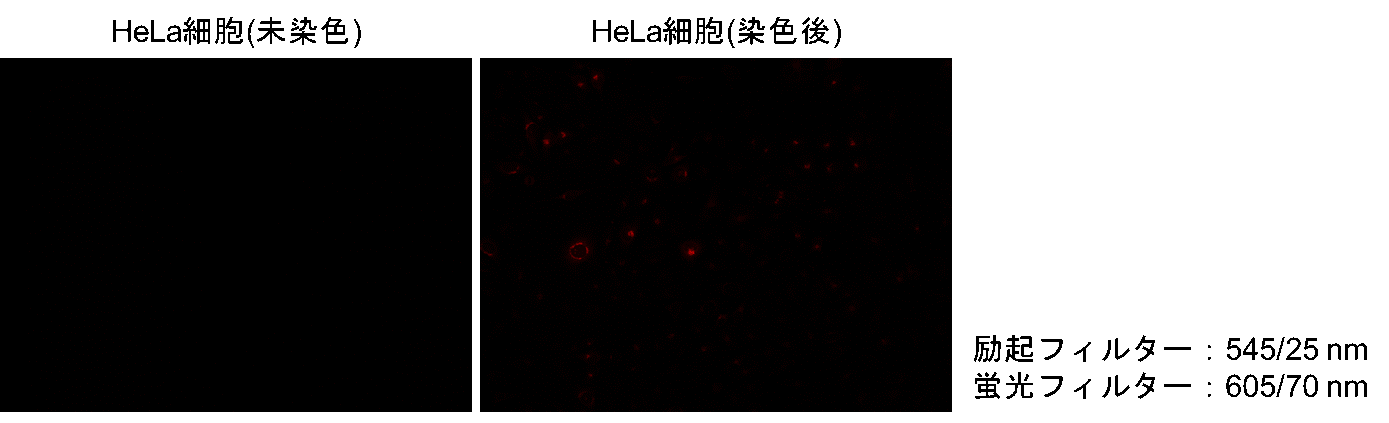
〈MitoBright LT Deep Redとの共染色プロトコル〉
1. ディッシュまたはマイクロプレートに播種した細胞を準備した。
2. 培地を除去し、無血清培地で2回洗浄した。
3. 無血清培地を添加し、インキュベーター(37℃、5%CO2存在下)で15分間静置した。
4. 上清を除去した後、Fatty Acid Uptake Probe working solutionを添加し、インキュベーター(37℃、5%CO2存在下)で15分間静置した。
5. 上清を除去した後、0.1 µmol/l MitoBright LT working solutionを添加し、インキュベーター(37℃、5%CO2存在下)で30分間静置した。
6. 上清を除去した後、HBSSを用いて2回洗浄した。
7. HBSSを添加し、蛍光顕微鏡で観察した。

-
Q
-
A
蛍光顕微鏡観察時、励起光を照射し続けるとFatty Acid Uptake Probe由来の蛍光が退色する可能性があります。連続した励起光の照射は控えてください。

取扱条件
関連製品
この製品に関連する研究では、下記の関連製品も使われています。
-
リソソーム染色色素 Green
LysoPrime Green – High Specificity and pH Resistance
-
ミトコンドリア染色用色素 Deep Red
MitoBright LT Deep Red
-
耐光性トータルROS検出キット
ROS Assay Kit -Photo-oxidation Resistant DCFH-DA-
-
α-ケトグルタル酸測定キット
α-Ketoglutarate Assay Kit-Fluorometric
-
MT-1ミトコンドリア膜電位検出キット
MT-1 MitoMP Detection Kit




 Fatty Acid Uptake Assay Kit
Fatty Acid Uptake Assay Kit