上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
C10H10N2
158.2
关联产品



上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
C10H10N2
158.2
关联产品



上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息


活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Caspase-3 Assay Kit-Colorimetric- 细胞凋亡检测
NO.2. Cell Viability Assay Kit 细胞增殖/毒性检测
NO.3. DNA Damage Quantification Kit -AP Site Counting DNA损伤定量检测
NO.4. ECGreen-Endocytosis Detection 外泌体细胞膜检测
NO.5. Cellular Senescence Detection Kit 细胞衰老检测
产品特性
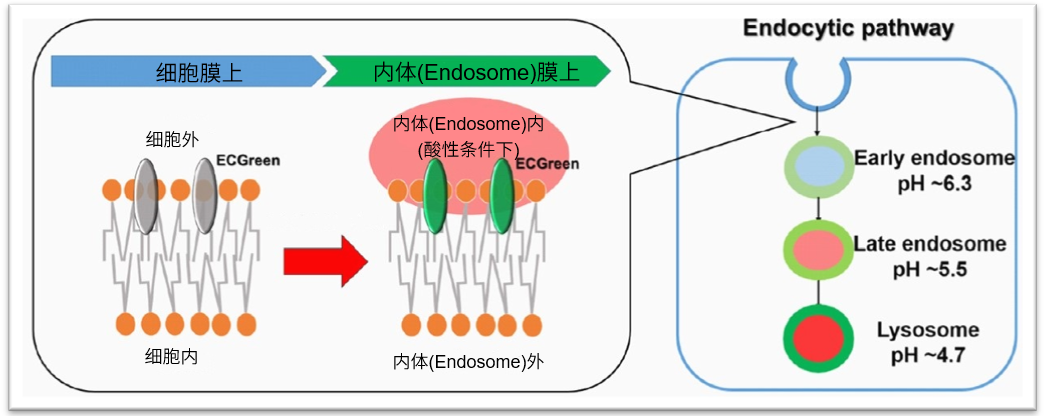
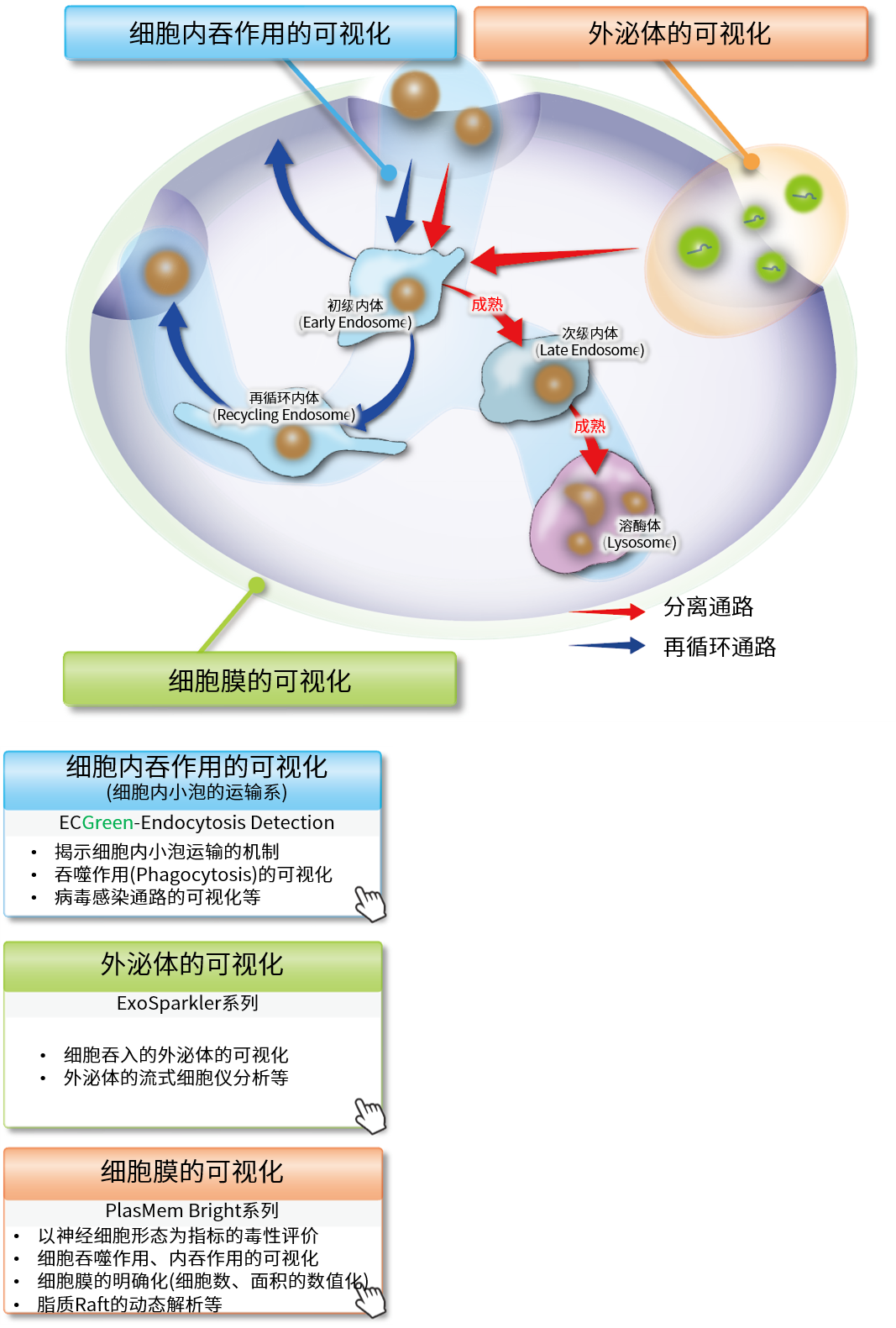
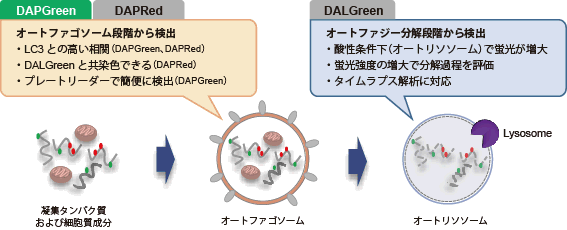
细胞内吞作用(Endocytosis)是一种通过细胞膜形成内体(Endosome)的细胞摄入机制。内吞作用不仅可以将各种营养物质摄入到细胞内,还可以将细胞内外的有害物质转运至溶酶体中分解,帮助维持细胞稳态。近年来的研究发现,内吞作用的紊乱与很多神经变异性疾病和免疫疾病密切相关,因此受到了广泛关注。而通过荧光探针标记细胞内吞作用摄入的葡聚糖,是最广泛使用的一种研究方法。但是由于葡聚糖的大小不固定,细胞摄入时的通路以及细胞内动力学都会随之发生变化。所以急需一种更准确的研究细胞内吞作用通路的方法。
ECGreen是一种细胞膜非透过性的小分子荧光染料,它可停留在细胞膜上。随着内吞作用进入细胞后,内体中的酸性环境会使它的荧光增强。与传统的标记葡聚糖的方法不同,ECGreen通过对内体的膜直接染色,可以更准确的进行活细胞内的内吞作用通路分析。
弥补了传统方法的缺点
目前最常用的细胞内吞作用可视化的方法是荧光标记葡聚糖或细胞膜,由于准确性差和停留时间短等缺点,在进行细胞内吞作用的动态观察时存在各种各样的问题。而ECGreen可以解决上述问题。
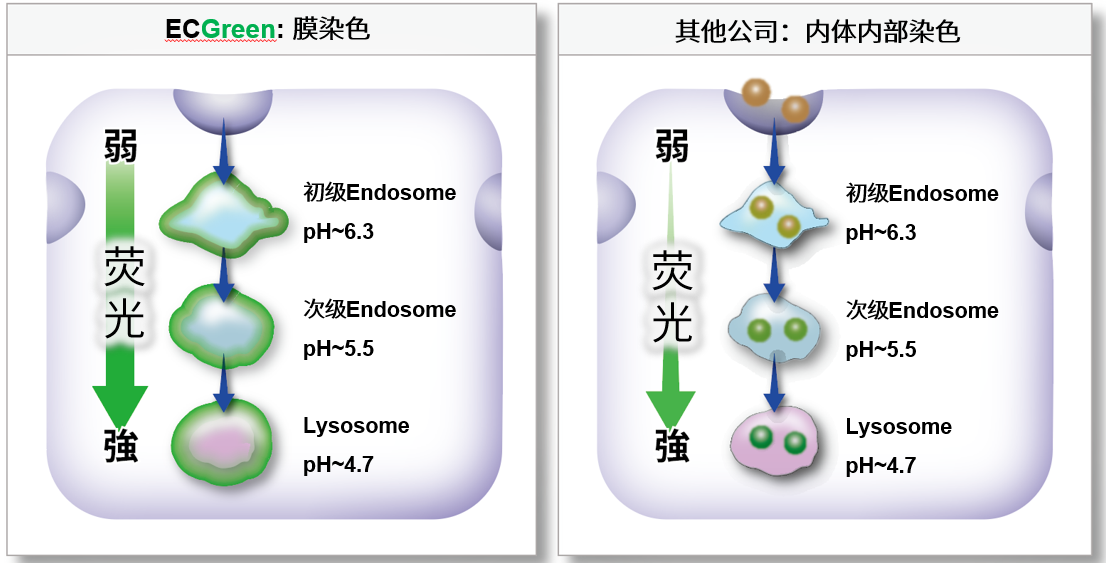
| 产品名 | Endosome | pH的应答性 | Lysosome |
| ECGreen-Endocytosis Detection | 内体的膜 | ECGreen>葡聚糖 | 可染色 |
| T公司产品P(葡聚糖荧光染料) | 内体内部 | 可染色 | |
| T公司产品C | 很少染色内体 | 无应答性 | 可染色 |
直接的内体(Endosome)可视化
ECGreen-Endocytosis Detection可以染色内体的膜,随着pH的变化荧光强度发生变化。因此与其他公司的通过标记蛋白质的方法相比,可以更直接的观察初级阶段的内体。
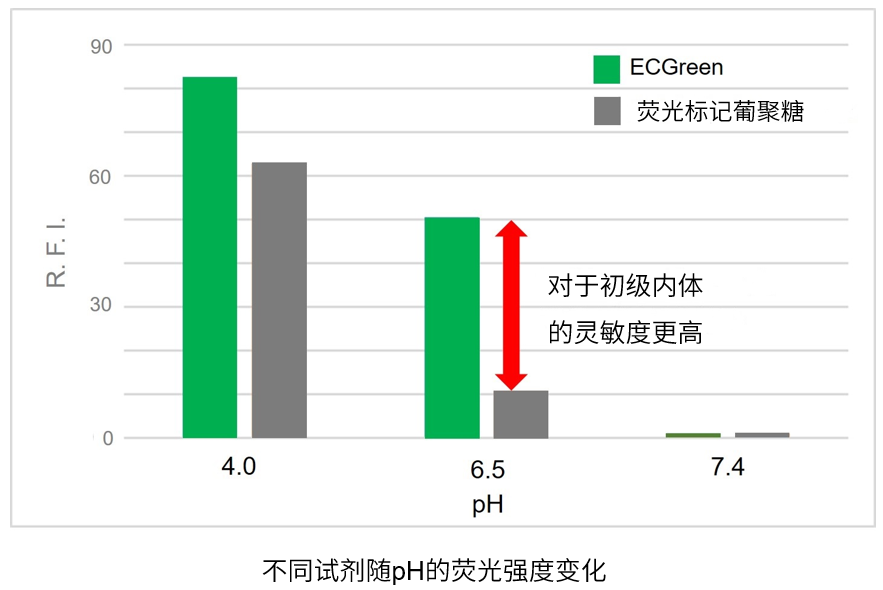
pH变化的应答性高
ECGreen-Endocytosis Detection与传统的荧光标记葡聚糖的方法相比,对pH变化的应答性更优秀。因此可以高灵敏的检测初级内体。
实验例
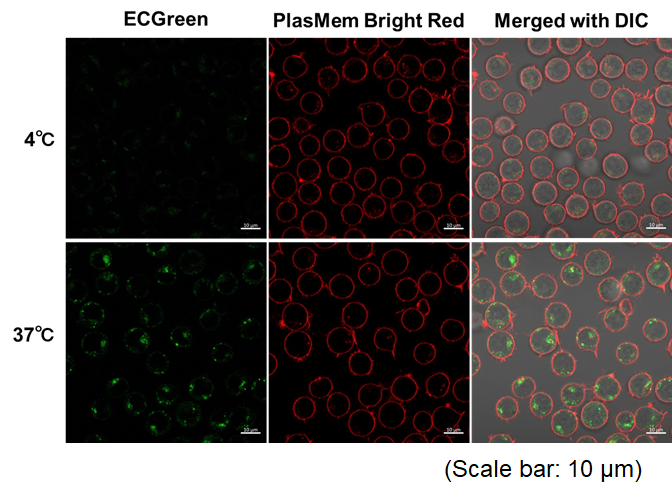
实验例:通过悬浮细胞观察内吞作用对温度依赖性的变化
本实验使用ECGreen内吞检测试剂(产品货号:E296)和PlasMem Bright Red(产品货号:P505)染色,对Jurkat细胞内吞时对温度的依赖性变化
<检测条件>
内体检测(ECGreen, 绿色): Ex. 405 nm / Em. 500 – 560 nm
细胞膜检测 (PlasMem Bright Red,红色): Ex. 561 nm / Em. 560 – 700 nm
<实验步骤>
(1)在样品管中加入Jurkat细胞悬液(10%FBS,RPMI)并在4℃或37℃孵育30min。
(2) 使用步骤(1)配置的细胞悬浮液将ECGreen溶液稀释1000倍。
(3) 4℃或37℃孵育30min。
(4) 用HBSS清洗细胞两次。
(5) 加入含有PlasMem Bright Red(100倍稀释)的培养基,悬浮细胞。
(6) 将悬浮液转移到成像板上,并使用共聚焦显微镜观察细胞。
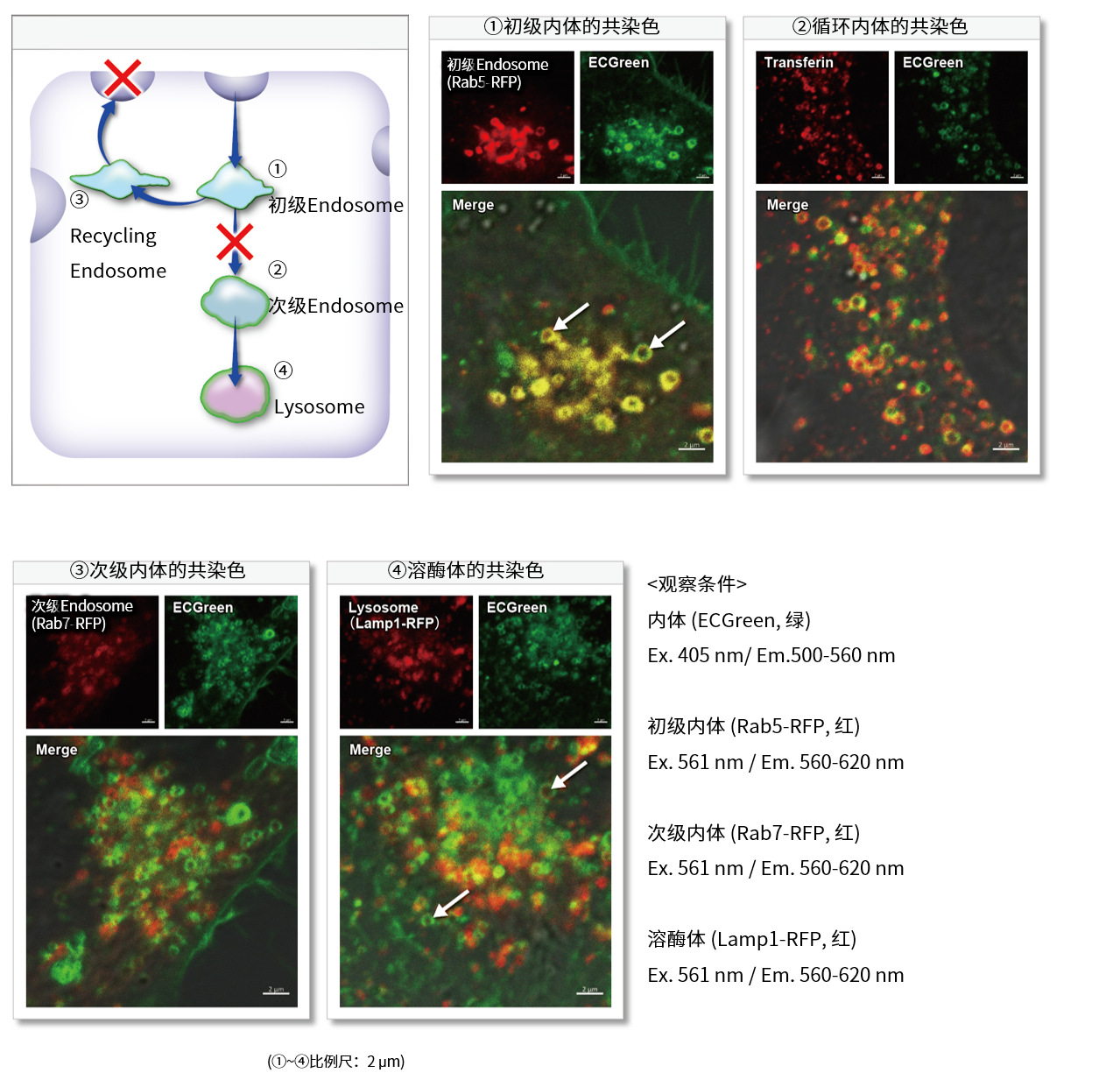
实验例:使用药物后初期内体的观察
Wortmannin是一种阻碍内体向循环内体(Recycling endosome)和溶酶体(Lysosome)转变的药物,可造成内体肥大。Wortmannin作用后通过ECGreen(绿)和下列试剂进行共染色。
初级内体(Early Endosome): Rab5-RFP(红)
循环内体(Recycling Endosome):荧光标记Transferrin(红)
次级内体(Late Endosome): Rab7-RFP(红)
溶酶体(Lysosome): Lamp1-RFP(红)
结果显示,ECGreen(绿)由于Wortmannin的作用仅与肥大化的初级内体和循环内体共同存在(图①和②),而不与次级内体和溶酶体共同存在(图③和④)。 因此,ECGreen可以准确可视化细胞内体的转运和形态变化。
实验例:内体局部实时观察
用共聚焦激光显微镜观察ECGreen时,即使染色后不清洗也可以观察到内吞作用产生的荧光亮点。 作为使用ECGreen的应用实验的一个例子,HeLa细胞用ECGreen(绿色)和溶酶体染色剂(红色)染色,并确认了成像图像的时间变化。
结果证实了随着时间的流逝,内体与溶酶体共定位。
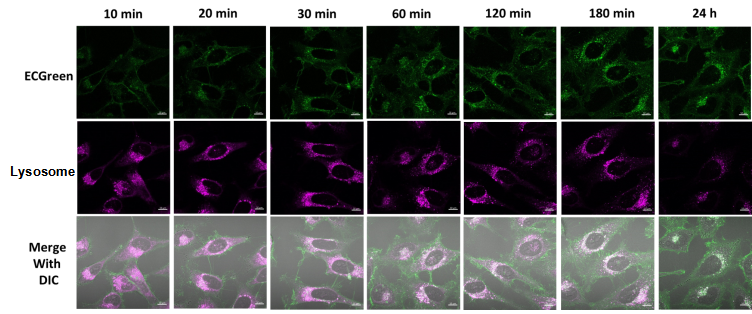
<观察条件>
内体 (ECGreen, 绿) Ex. 405 nm / Em. 500-560 nm
溶酶体 (Lysosome染色试剂, 红) Ex. 561 nm / Em. 600-700 nm

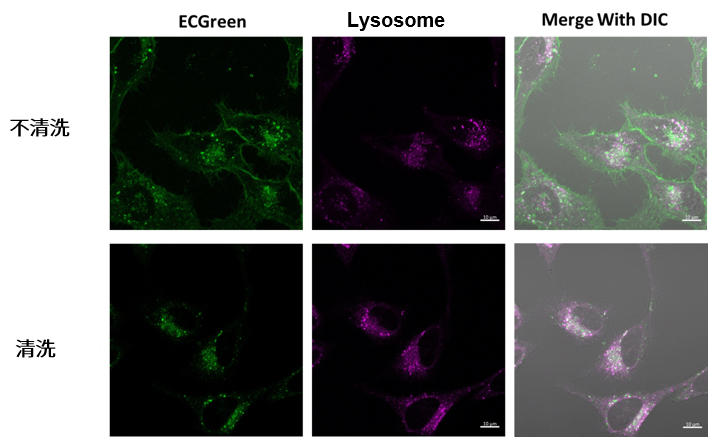
清洗后观察和不清洗观察,所获得的成像图像具有以下特征。
〇染色后不洗:
由于染料可以保留在细胞膜中,因此可以随时间观察内吞状态。
那时,在细胞膜上也观察到荧光亮点,因为过量的染料残留在膜上。
〇染色后清洗:
通过去除残留在细胞膜上的多余染料,可以更清楚地观察到来自内吞作用的荧光亮点
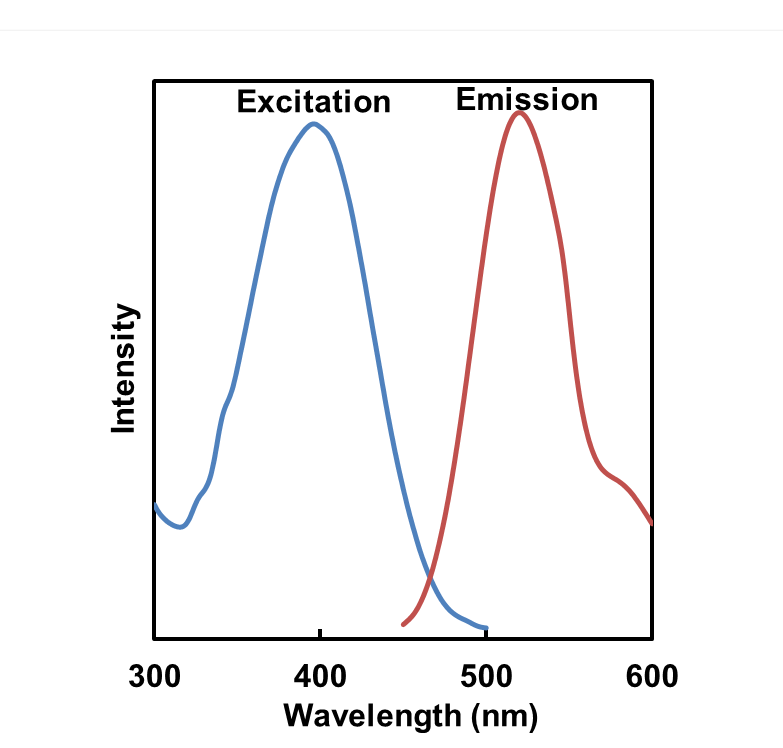
ECGreen的荧光特性
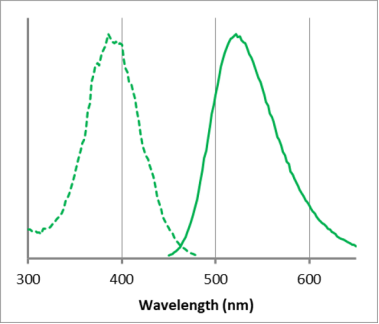
λex: 386 nm, λem: 522 nm
<观察条件>
Ex. 350~410 nm / Em. 500-560 nm
关联产品
常见问题Q&A
| Q1: 可以使用落射型显微镜观察吗? |
| A:建议使用共焦显微镜进行观察,但是也可以用落射型显微镜进行观察。本公司有在DAPI通道(Ex:360/40nm,Em:460/50nm)检测的实例。
|
| Q2: 可以使用含血清的培养基进行染色吗? |
| A: 可以使用含血清的培养基。
对HeLa细胞,使用含有血清的培养基制作的working solution,在24小时内进行染色,发现无细胞毒性。 细胞毒性已使用本公司Cell Counting Kit-8确认。
|
产品文献
1、Y. Miyakawa, M. Otsuka, K. Sekiba, K. Funato, K. Koike, “Humanized virus-suppressing factor inhibits hepatitis B virus infection by targeting viral cell entry”, Heliyon, 2021, doi:10.1016/j.heliyon.2021.e07586.
2、H. L. Marko, N. C. Hornig, R. C. Betz, P. Holterhus, J. Altmüller, H. Thiele, M. Fabiano, H. Schweikert, D. Braun, Ul Schiweizer, “Genomic variants reducing expression of two endocytic receptors in 46,XY differences of sex development”, Hum. Mutat. 2022, doi:10.1002/humu.24325.
3、K. Qiu, R. Seino, G. Han, M. Ishiyama, Y. Ueno, Z. Tian, Y. Sun, J. Diao, “De Novo Design of A Membrane-Anchored Probe for Multidimensional Quantification of Endocytic Dynamics”, Adv. Healthcare Mater., 2022, doi:10.1002/adhm.202102185.
关联产品



上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
特点:
● 只需添加小分子量荧光试剂即可轻松检测线粒体
● 可以使用荧光显微镜进行活细胞成像
● 可以与附着的溶酶体染色剂同时染色


活动进行中
订购满5000元,200元礼品等你拿
线粒体自噬大揭秘丨从实验思路到检测指标 PDF下载
| 关联指标干货参考(点击查看) | 检测指标(点击查看) | |
| 线粒体自噬详述 | Mitophagy Detection Kit(本产品) | |
| 多细胞器共染&线粒体动力学 | MitoBright IM Red for Immunostaining | |
| MitoBright LT Green/Red/Deep Red | ||
| 线粒体功能 | JC-1 、MT-1 | |
| CCK-L、ADP/ATP比率检测 | ||
| Oxygen Consumption Rate(OCR) | ||
| mtSOX | ||
| ROS Assay Kit -Highly Sensitive DCFH-DA- | ||
| ROS Assay Kit -Photo-oxidation Resistant DCFH-DA- | ||
| Ca2+从内质网到线粒体 | Fura 2-AM | |
| Fluo 4-AM | ||
| Rhod 2-AM | ||
| 线粒体自噬-溶酶体功能 | Lysosomal Acidic pH Detection Kit | |
| Lysosomal Acidic pH Detection Kit-Green/Deep Red | ||
| 线粒体自噬-脂质定位&定量 | Lipi-Blue/Green/Red/Deep Red | |
| Lipid Droplet Assay Kit-Blue/Deep Red | ||
| 细胞死亡 | Cell Counting Kit-8 | |
| Cytotoxicity LDH Assay Kit-WST | ||
| Annexin V, FITC Apoptosis Detection Kit | ||
*点击即可跳转至详情页
试剂盒内含
产品概述
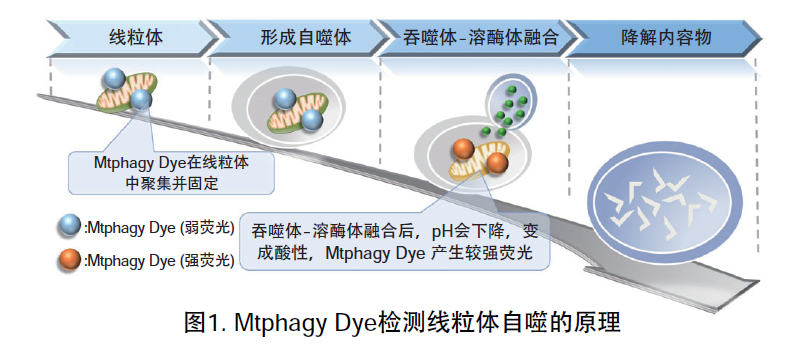
线粒体 (Mitochondria) 是细胞中重要的细胞器之一,可以为细胞活力提供能量 。近年有报道去极化线粒体的积累引起的阿尔茨海默病 (Alzheimer’s Disease) 与帕金森病(Parkinson’s Disease),可能与线粒体自噬有关。线粒体自噬是一种清除机制,可以通过自噬,将氧化应激、DNA损伤因素导致功能失调的线粒体隔离包裹成自噬体(Autophagosome),再与溶酶体 (Lysosome) 融合后降解。本试剂盒内含Mtphagy Dye (用于检测线粒体自噬) 和Lyso Dye (溶酶体染料)。Mtphagy Dye通过化学结合,固定在细胞内的线粒体上,会发出较弱的荧光。当线粒体发生自噬,损伤的线粒体会与溶酶体融合,pH会下降,变成酸性,此时Mtphagy Dye会产生较强的荧光。如想直观观察Mtphagy Dye标记的线粒体和溶酶体的结合,可联合应用试剂盒中的Lyso Dye (标记溶酶体) 进行双染。
特点:
1)只需添加小分子量荧光试剂即可轻松检测线粒体
2)可以使用荧光显微镜进行活细胞成像
3)可以与附着的溶酶体染色剂同时染色
原理
记载了本产品的检测原理和实验例的论文请看MD01论文实验例中第四篇:Live Cell Imaging of Mitochondrial Autophagy with a Novel Fluorescent Small Molecule
实验例
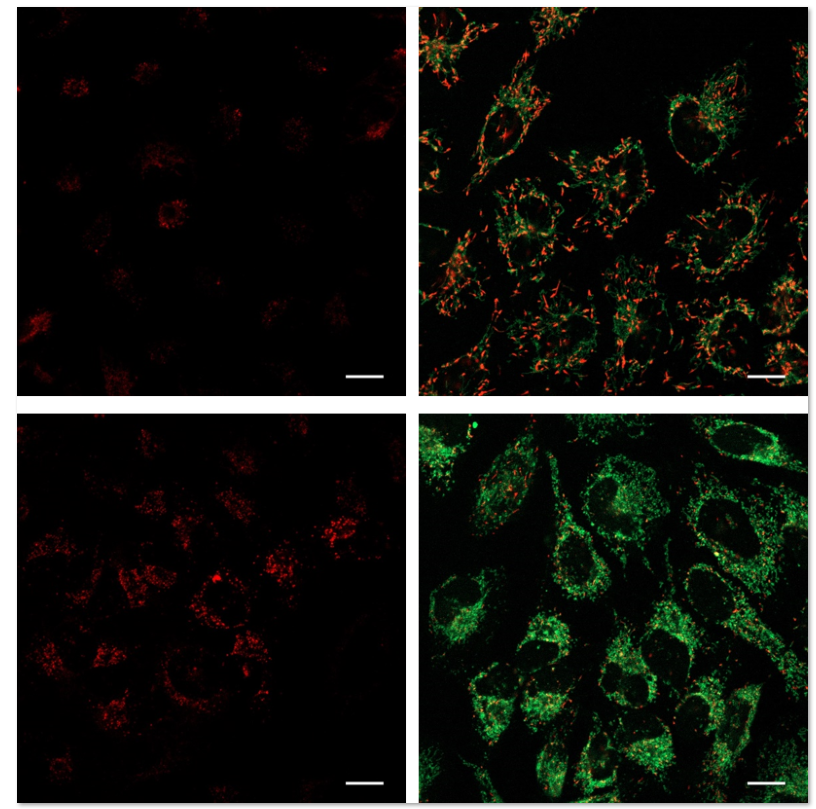
1.用羰基氰化物间氯苯腙 (CCCP,一种线粒体解偶联剂) 诱导Parkin表达的HeLa细胞线粒体自噬,并通过荧光显微镜进行检测。另外,通过与线粒体染色试剂(MitoBright Deep Red:MT08)一同染色,能够区分出已发生自噬的的线粒体(白色)和未发生自噬的线粒体(紫色)(照片:右侧)。
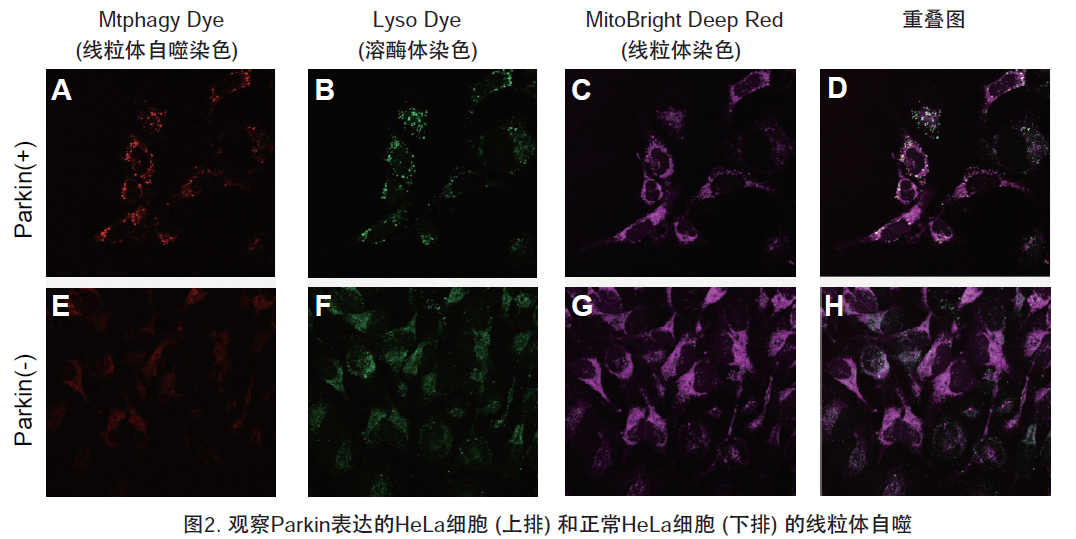
波长:
Mtphagy Dye:561 nm (Ex)、650 LP nm (Em)
Lyso Dye:488 nm (Ex)、502-554 nm (Em)
MitoBright Deep Red:640 nm (Ex)、656-700 nm (Em)
2.荧光显微镜观察
HeLa细胞用CCCP处理,并与线粒体检测试剂(Mtphagy Dye)和线粒体染色试剂(MitoBright LT Green)共同染色,并经过一段时间(6小时)后进行检测。
<检测条件>
设备:LSM-700 Laser scanning confocal microscope (LSCM)
(Carl Zeiss, Oberkochen, Germany)
激发波长:
MitoBright LT Green 488 nm
Mtphagy Dye 555 nm
物镜:63x
拍摄时间:6小时
拍摄间隔:15秒
3.自噬诱导和线粒体膜电位变化关系的检测
用羰基氰化物间氯苯腙(CCCP,一种线粒体解偶联剂)诱导Parkin表达的HeLa细胞线粒体自噬,并使用线粒体自噬检测试剂盒(Mitophagy Detection Kit:MD01)和线粒体膜电位检测试剂盒(JC-1 MitoMP Detection Kit:MT09)观察荧光结果。
结果证实在未经CCCP处理的细胞中几乎未检测到线粒体自噬的发生,并且线粒体膜电位正常维持。 另一方面,在添加了CCCP的细胞中,证实了线粒体膜电位的降低(JC-1的红色荧光降低)和线粒体自噬的发生(Mtphagy染料的荧光增强)。
<实验条件>
■将Parkin质粒导入HeLa细胞
使用HilyMax(货号:H357)将Parkin质粒引入HeLa细胞中(Parkin质粒/HilyMax试剂:0.1 μg/0.2 μl)
过夜培养后进行检测。
■线粒体自噬检测
向表达Parkin的HeLa细胞中添加0.1 μmol/l Mtphagy工作溶液,并在37°C下孵育30分钟。然后将细胞用HBSS洗涤,加入10 μg/ml CCCP/MEM溶液,并在37℃下孵育2小时。在荧光显微镜下观察细胞。
■线粒体膜电位检测
将10 μg/ml的CCCP/MEM溶液添加至表达Parkin的HeLa细胞中,并在37℃下孵育1.5小时。加入4 μmol/l的JC-1工作液使其终浓度达到2 μmol/l,并在37℃下孵育30分钟。孵育后,将细胞用HBSS洗涤,加入成像缓冲液,并在荧光显微镜下观察细胞。
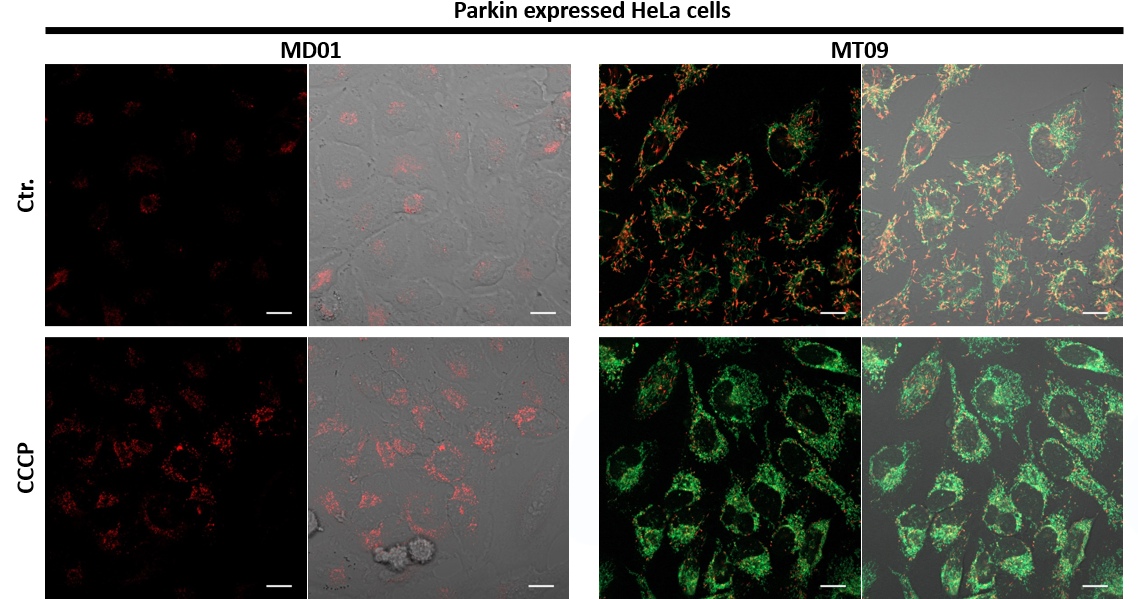
<检测条件>
■线粒体自噬检测
Ex:561 nm,Em:570-700 nm
■线粒体膜电位检测
绿色Ex:488 nm,Em:500-550 nm
红色Ex:561 nm,Em:560-610 nm
荧光特性
参考文献
| 序号 | 检测对象 | 使用仪器 | 文献 |
| 1) | 细胞(HeLa) | 流式细胞仪 | J. Koniga, C. Otta, M. Hugoa, T. Junga, A. L. Bulteaub, T. Grunea and A. Hohna, “Mitochondrial contribution to lipofuscin formation”, Redox Biology, 2017, 11, 673. |
| 2) | 细胞(KB) | 荧光显微镜 | K. Kameyama, “Induction of mitophagy-mediated antitumor activity with folate-appended methyl-β-cyclodextrin”, International Journal of Nanomedicine, 2017, 12, 3433. |
| 3) | 细胞(SH-SY5Y, 初代皮质神经细胞) | 荧光显微镜 | E. F. Fang, T. B. Waltz, H. Kassahun, Q. Lu, J. S. Kerr, M. Morevati, E. M. Fivenson, B. N. Wollman, K. Marosi, M. A. Wilson, W. B. Iser, D. M. Eckley, Y. Zhang, E. Lehrmann, I. G. Goldberg, M. S. Knudsen, M. P. Mattson, H. Nilsen, V. A. Bohr and K. G. Becker, “Tomatidine enhances lifespan and healthspan in C. elegans through mitophagy induction via the SKN-1/Nrf2 pathway”, Scientific Reports, 2017, 7, (46208), DOI: 10.1038/srep46208. |
| 4) | 细胞(HeLa、Parkin表达HeLa) | 荧光显微镜 | H. Iwashita, S. Torii, N. Nagahora, M. Ishiyama, K. Shioji, K. Sasamoto, S. Shimizu and K. Okuma, “Live Cell Imaging of Mitochondrial Autophagy with a Novel Fluorescent Small Molecule”, ACS Chem. Biol., 2017, 12, (10), 2546. |
| 5) | 细胞(Cardiomyocytes) | 流式细胞仪 | Y. Feng, NB. Madungwe, CV. da Cruz Junho and JC. Bopassa, “Activation of G protein-coupled oestrogen receptor 1 at the onset of reperfusion protects the myocardium against ischemia/reperfusion injury by reducing mitochondrial dysfunction and mitophagy.”, Br. J. Pharmacol., 2017, 174, (23), 4329. |
| 6) | 细胞(HCT116) | 荧光显微镜 | K. M. Elamin, K. Motoyama, T. Higashi, Y. Yamashita, A. Tokuda and H. Arima, “Dual targeting system by supramolecular complex of folate-conjugated methyl-β-cyclodextrin with adamantane-grafted hyaluronic acid for the treatment of colorectal cancer.”, Int. J. Biol. Macromol., 2018, doi: 10.1016/j.ijbiomac.2018.02.149. |
| 7) | 细胞(Parkin-HeLa) | 流式细胞仪 | N. Furuya, S. Kakuta, K. Sumiyoshi, M. Ando, R. Nonaka, A. Suzuki, S. Kazuno, S. Saiki and N. Hattori, “NDP52 interacts with mitochondrial RNA poly(A) polymerase to promote mitophagy.”, EMBO Rep. ., 2018, doi: 10.15252/embr.201846363. |
| 8) | 细胞(NKT) | 流式细胞仪 | L. Zhu, X. Xie, L. Zhang, H. Wang, Z. Jie, X. Zhou, J. Shi, S. Zhao, B. Zhang, X. Cheng and S. Sun, “TBK-binding protein 1 regulates IL-15-induced autophagy and NKT cell survival”, Nature Communications., 2018, 9, (1), doi:10.1038/s41467-018-05097-5. |
| 9) | 细胞(HeLa) | 流式细胞仪 | K. Araki, K. Kawauchi, W. Sugimoto, D. Tsuda, H. Oda, R. Yoshida and K. Ohtani, “Mitochondrial protein E2F3d, a distinctive E2F3 product, mediates hypoxia-induced mitophagy in cancer cells”, Commun Biol., 2019, DOI: 10.1038/s42003-018-0246-9. |
| 10) | 细胞(Bovine Sertoli) | 荧光显微镜 | E. Adegoke, S. Adeniran, Y. Zeng, X. Wang, H. Wang, C. Wang, H. Zhang, P. Zheng and G. Zhang , “Pharmacological inhibition of TLR4/NF-κB with TLR4-IN-C34 attenuated microcystin-leucine arginine toxicity in bovine Sertoli cells.”, J Appl Toxicol., 2019,doi: 10.1002/jat.3771. |
| 11) | 组织(小鼠) | 荧光显微镜 | E. F. Fang, Y. Hou, K. Palikaras, B. A. Adriaanse, J. S. Kerr, B. Yang, S. Lautrup, M. M. Hasan-Olive, D. Caponio, X. Dan, P. Rocktaschel, D. L. Croteau, M. Akbari, N. H. Greig, T. Fladby, H. Nilsen, M. Z. Cader, M. P. Mattson, N. Tavernarakis and V. A. Bohr, “Mitophagy inhibits amyloid-β and tau pathology and reverses cognitive deficits in models of Alzheimer’s disease.”, Nat. Neurosci. ., 2019,DOI:10.1038/s41593-018-0332-9. |
| 12) | 细胞(HepG2) | 荧光显微镜 | Iwasawa, T. Shinomiya, N. Ota, N. Shibata, K. Nakata, I. Shiina, and Y. Nagahara , “Novel Ridaifen-B Structure Analog Induces Apoptosis and Autophagy Depending on Pyrrolidine Side Chain”, Biological and Pharmaceutical Bulletin., 2019, 42, (3), 401-410, doi: 10.1248/bpb.b18-00643. |
| 13) | 细胞(U2OS) | 荧光显微镜 | T. Namba, “BAP31 regulates mitochondrial function via interaction with Tom40 within ER-mitochondria contact sites “, Sci Adv., 2019, 5, (6), 1386. |
| 14) | 细胞(INS-1) | 荧光显微镜 | A. Inamura, S. M. Hirayama, and K. Sakurai, Loss of Mitochondrial DNA by Gemcitabine Triggers Mitophagy and Cell Death’, Biol. Pharm. Bull.., 2019, 42, 1977. |
| 15) | 细胞(HRCEpiC, HRPTEpic) | 流式细胞仪 | Y. Zhao and M. Sun, Metformin rescues Parkin protein expression and mitophagy in high glucose-challenged human renal epithelial cells by inhibiting NF-κB via PP2A activation., Life Sci.., 2020, DOI:10.1016/j.lfs.2020.117382. |
| 16) | 细胞(RAES) | 荧光显微镜 | N. Liu, J. Wu, L. Zhang, Z. Gao, Y. Sun, M. Yu, Y. Zhao, S. Dong, F. Lu and W. Zhang , “Hydrogen Sulphide modulating mitochondrial morphology to promote mitophagy in endothelial cells under high‐glucose and high‐palmitate “, J. Cell. Mol. Med., 2017, 21, (12), 3190. |
| 17) | 细胞(BAECs) | 荧光显微镜 | N. Kajihara, D. Kukidome, K. Sada, H. Motoshima, N. Furukawa, T. Matsumura, T. Nishikawa and E. Araki, “Low glucose induces mitochondrial reactive oxygen species via fatty acid oxidation in bovine aortic endothelial cells”, J Diabetes Investig, 2017, 8, (6), 750. |
| 18) | 细胞(HT22) | 荧光显微镜 | M. Jin, H. Ni and L. Li, “Leptin Maintained Zinc Homeostasis Against Glutamate-Induced Excitotoxicity by Preventing Mitophagy-Mediated Mitochondrial Activation in HT22 Hippocampal Neuronal Cells.”, Front Neurol, 2018, 9, (9), 332. |
| 19) | 细胞(BMDMs) | 流式细胞仪 | D. Bhatia, K. P. Chung, K. Nakahira, E. Patino, M. C. Rice, L. K. Torres, T. Muthukumar, A. M. Choi, O. M. Akchurin and M. E. Choi , “Mitophagy-dependent macrophage reprogramming protects against kidney fibrosis”, JCI Insight, 2019, 4, (23), e132826. |
| 20) | 细胞(U2OS) | 荧光显微镜 | J. Zheng, D. L. Croteau, V. A. Bohr and M. Akbari, “Diminished OPA1 expression and impaired mitochondrial morphology and homeostasis in Aprataxin-deficient cells. “, Nucleic Acids Res., 2019, 47, (8), 4086. |
| 21) | 细胞(HT22) | 荧光显微镜 | D. D. Wang, M. F. Jin, D. J. Zhao and H. Ni, “Reduction of Mitophagy-Related Oxidative Stress and Preservation of Mitochondria Function Using Melatonin Therapy in an HT22 Hippocampal Neuronal Cell Model of Glutamate-Induced Excitotoxicity”, Front Endocrinol (Lausanne), 2019, 10, 550. |
| 22) | 细胞(CD4+T-cells, HeLa) | 荧光显微镜 | A. Bektas, S. H. Schurman, M. G. Freire, A. Bektas, S. H. Schurman, M. G. Freire, C. A. Dunn, A. K. Singh, F. Macian, A. M. Cuervo, R. Sen and L. Ferrucci, “Age-associated changes in human CD4+ T cells point to mitochondrial dysfunction consequent to impaired autophagy.”, Aging (Albany NY)., 2019, 11, (21), 9234-9263. |
| 23) | 细胞(ALM) | 流式细胞仪 | T. Nechiporuk, S.E. Kurtz, O. Nikolova, T. Liu, C.L. Jones, A. D. Alessandro, R. C. Hill, A. Almeida, S. K. Joshi, M. Rosenberg, C. E. Tognon, A. V. Danilov, B. J. Druker, B. H. Chang, S. K McWeeney and J. W. Tyner, “The TP53 Apoptotic Network Is a Primary Mediator of Resistance to BCL2 Inhibition in AML Cells.”, Cancer Discov., 2019, 9, (7), 919. |
| 24) | 细胞(PK-15) | 荧光显微镜 | Y. Zhang, R. Sun, X. Li and W. Fang, “Porcine Circovirus 2 Induction of ROS Is Responsible for Mitophagy in PK-15 Cells via Activation of Drp1 Phosphorylation”, Viruses., 2020, 12, (3), 289. |
| 25) | 细胞(HCE) | 荧光显微镜 | Y. Huo, W. Chen, X. Zheng, J. Zhao, Q. Zhang, Y. Hou, Y. Cai, X. Lu and X. Jin , “The protective effect of EGF-activated ROS in human corneal epithelial cells by inducing mitochondrial autophagy via activation TRPM2.”, J. Cell. Physiol., 2020, DOI: 10.1002/jcp.29597. |
| 26) | 细胞(心肌细胞) | 荧光显微镜 | Y. Sun, F. Lu, X. Yu, B. Wang, J. Chen, F. Lu, S. Peng, X. Sun, M. Yu, H. Chen, Y. Wang, L. Zhang, N. Liu, H. Du, D. Zhao and W. Zhang, “Exogenous H2S Promoted USP8 Sulfhydration to Regulate Mitophagy in the Hearts of db/db Mice.”, Aging Dis., 2020, 11, (2), 269. |
| 27) | 细胞(HCFs) | 荧光显微镜 | R. Tanaka, M. Umemura, M. Narikawa, M. Hikichi, K. Osaw, T. Fujita, U. Yokoyama, T. Ishigami, K. Tamura and Y. Ishikawa, “Reactive fibrosis precedes doxorubicin-induced heart failure through sterile inflammation.”, ESC Heart Fail., 2020, 7, (2), 588. |
| 28) | 细胞(VSMCs) | 荧光显微镜 | C. Duan, L. Kuang, X. Xiang, J. Zhang, Y. Zhu, Y. Wu, Q. Yan, L. Liu and T. Li, “Drp1 regulates mitochondrial dysfunction and dysregulated metabolism in ischemic injury via Clec16a-, BAX-, and GSH- pathways “, Cell Death Dis., 2020, 11, 251. |
| 29) | 细胞(Bovine Sertoli) | 荧光显微镜 | E. O. Adegoke, W. Xue, N. S. Machebe, S. O. Adeniran, W. Hao, W. Chen, Z. Han, Z. Guixue and Z. Peng, “Sodium Selenite inhibits mitophagy, downregulation and mislocalization of blood-testis barrier proteins of bovine Sertoli cell exposed to microcystin-leucine arginine (MC-LR) via TLR4/NF-kB and mitochondrial signaling pathways blockage.”, Ecotoxicol. Environ. Saf., 2018, 116, 165. |
| 30) | 细胞(HeLa) | 荧光显微镜 | D. Takahashi, J. Moriyama, T. Nakamura, E. Miki, E. Takahashi, A. Sato, T. Akaike, K. I. Nakama and H. Arimoto, “AUTACs: Cargo-Specific Degraders Using Selective Autophagy. “, Mol. Cell, 2019, 76, (5), 797. |
| 31) | 细胞(primary hepatocyte) | 荧光显微镜 | H. Kim, J. H. Lee and J. W. Park, “IDH2 deficiency exacerbates acetaminophen hepatotoxicity in mice via mitochondrial dysfunction-induced apoptosis.”, Biochim Biophys Acta Mol Basis Dis, 2019, 1865, (9), 2333. |
| 32) | 细胞(C3H10T1/2s) | 荧光显微镜 | M. S. Rahman and Y. S. Kim, “PINK1-PRKN mitophagy suppression by Mangiferin promotes a brown-fat-phenotype via PKA-p38 MAPK signalling in murine C3H10T1/2”, Metabolism, 2020, 101, 154228. |
| 33) | 细胞(NHEKs) | 荧光显微镜 | S. Ikeoka and A. Kiso , “The Involvement of Mitophagy in the Prevention of UV-B-Induced Damage in Human Epidermal Keratinocytes “, J. Soc. Cosmet. Chem. Jpn., 2020, 54(3), 252. |
常见问题Q&A
|
Q1: 本试剂盒和现存传统方法相比有何优势? |
| A1: 与PH敏感并基于Keima荧光蛋白检测方法相比,本试剂为小分子荧光试剂,因此无需表达荧光蛋白。
另外,可以通过与用于普通活细胞成像的荧光试剂用相同的操作方法对其进行染色和共同观察。 |
| Q2: 使用DMSO配置后的储存液稳定性如何? |
| A2:Mtphagy Dye、Lyso Dye均在制备后需保存在-20℃情况下可以稳定保存1个月。建议按照实验用量,
提前分装保存。 |
| Q3: 工作液稳定性如何 |
| A3: 无法保存,建议现配现用。 |
| Q4: 培养基中有酚红会影响检测吗? |
| A4:观察的时候,如果使用共聚焦激光显微镜的话,几乎不会受到酚红的影响,但是使用落射型荧光显微
镜的话,会观察到酚红色的背景。(参照以下观察数据)因此使用落射型荧光显微镜时,请在Working solution进行染色时使用不含酚红的培养基或HBSS。
|
| Q5: 荧光显微镜推荐的滤镜是什么? |
| A5:根据各种试剂推荐以下波长。Mtphagy Dye:激发(500~560 nm)、发射(670~730 nm)
Lyso Dye:激发(350~450 nm)、发射(500~560 nm) |
| Q6:与其他深红色染料共同染色时的注意事项。 |
| A6:Mtphagy Dye比一般的红色系荧光染料相比波长更长,所以和Deep Red的荧光染料一起染色的时候
需要特别注意。即Mtphagy Dye在500–560 nm处激发,可在670-730 nm处检测到荧光,这时与 MitoBright Deep Red的荧光检测波长重叠。因此,有必要在不激发深红色染料的波长下激发Mtphagy 染料,同时在不激发Mtphagy染料的波长下激发深红色染料。 [泄漏的情况] ① 制备仅添加了MitoBright Deep Red(没有添加Mtphagy Dye)的细胞。 ② 通过观察MitoBright Deep Red的激发/发射波长,确认是否观察到荧光(右下图)。 ③ 用Mtphagy Dye的激发/发射波长观察,确认是否观察到荧光(左下图)。 和③中,观察到来自MitoBright Deep Red的荧光(左下图)。 *如果如上所述确认荧光泄漏,请参阅以下内容。 ○调整激发/发射波长 如以上确认如图所示,MitoBright Deep Red也在Ex 561 nm处激发,因此可以将Mtphagy Dye的激发 波长更改为接近激光器或滤光片的500 nm,以使MitoBright深红色不被激发。 调整荧光强度和荧光检测灵敏度 如果MitoBright Deep Red的荧光泄漏到Mtphagy染料的观察波长中,请将观察过程中的激发强度或 灵敏度降低到未观察到荧光的水平。 然后,再确认改变后的观察条件下可以检测Mtphagy Dye的荧光。 [如何检查泄漏] 使用Mtphagy Dye,Lyso dye(溶酶体染色剂),MitoBrightLT Deep Red(线粒体染色剂) 进行三重染色时进行确认 1.在3个培养皿或孔中制备细胞。 (Mtphagy Dye、Lyso Dye、MitoBright Deep Red分别在在不同的皿或孔中进行染色) 2.向每个孔中添加Mtphagy Dye和MitoBright Deep Red。 (在无血清培养基中) 3.在37°C下孵育30分钟。 4.进行自噬诱导条件下(如饥饿培养等)进行培养。 5.向上述2.中未使用的细胞添加Lyso Dye。(在无血清培养基中) 6.在37°C下孵育30分钟。 7.观察每种试剂的激发波长和荧光波长以及荧光强度。 8.检查所用试剂以外的观察波长处的荧光是否没有泄漏。 [观察条件] Lyso Dye:Ex:350-450 nm,Em:500-560 nm Mtphagy Dye:Ex : 500-560 nm,Em :670-730 nm MitoBright Deep Red:Ex :640 nm,Em :656-700 nm |
关联产品
上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
特点:
● 灵敏度高
● 易上手
● 多种仪器均可检测


产品解说
活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Cell Counting Kit-8 细胞增殖毒性检测
NO.2. ROS Assay Kit 活性氧检测
NO.3. FerroOrange 细胞亚铁离子检测
NO.4. GSSG/GSH Quantification Kit II 氧化型/还原型谷胱甘肽
NO.5. Mitophagy Detection Kit 线粒体自噬检测
试剂盒内含

产品概述
细胞中的线粒体作为有氧呼吸产生ATP的主要场所,是体内重要的细胞器之一,常被用于早期细胞毒性、氧化应激、细胞凋亡等研究中1)。线粒体活性的降低与机能失调,已被证实与癌症、衰老、神经退行性疾病 (如阿尔兹海默症、帕金森病等) 等密切相关2)3)。
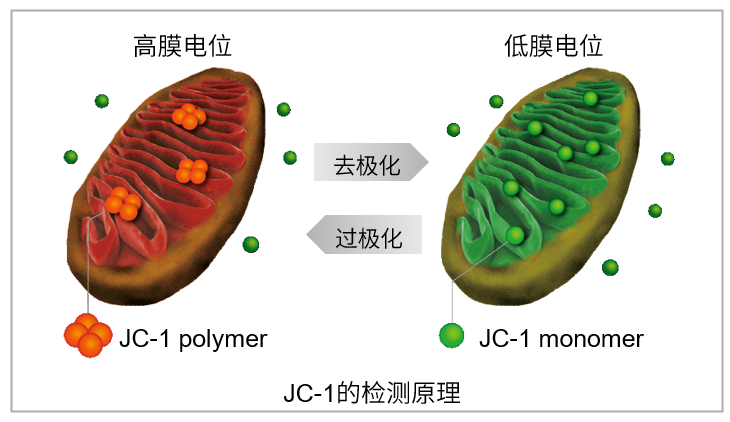
JC-1是一种被广泛使用的小分子线粒体膜电位探针,依赖于线粒体膜电位在线粒体中聚集,染料伴随聚集过程,荧光从绿色 (530 nm) 变为红色 (590 nm)。当线粒体发生去极化,红/绿荧光强度比值降低。以往的研究者反映,JC-1不易溶于水并有大量沉淀产生。但与其他公司的产品不同,同仁化学研究所研制的JC-1试剂解决了这一问题,避免了沉淀的产生。同时使用试剂盒中配制的成像缓冲液 (Imaging Buffer),可大幅降低荧光背景并在检测过程中保护细胞不受损伤。
当JC-1工作液的浓度为2 μmol/l, 每次用量为100 μl时,可以检测500次。
产品特点
1.为什么要检测线粒体膜电位
线粒体不仅是细胞内产生能量的场所,它还与癌症、衰老、阿尔兹海默症、帕金森等神经变异性疾病密切相关。因此,针对线粒体状态的研究非常重要,其中线粒体膜电位的变化经常被作为重要的指标之一检测。
当线粒体正常、膜电位差保持不变时,JC-1会聚集并发出红色荧光,而当膜电位降低时,JC-1会作为单体存在并发出绿色荧光。红色和绿色荧光强度的变化可以作为检测线粒体状态的指标。
2.初次使用也很容易上手

3.去极化的检测实例
使用去极化剂carbonylcyanide-p-trifluoromethoxyphenylhydrazone(FCCP)对HeLa细胞进行处理,用本试
剂盒进行检测。可以发现与未加药物的细胞相比,加药组细胞的红色荧光明显减少。
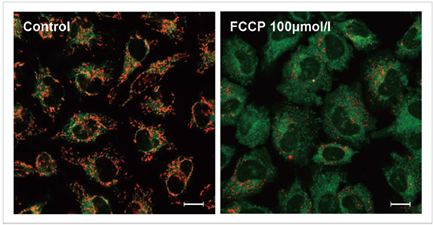
实验条件
JC-1浓度: 2 μmol/l in MEM, 染色时间30 min
FCCP浓度:100 μmol/l, FCCP处理时间1 h
检测条件
Green : Ex 488 nm/ Em 500-550 nm;
Red : Ex 561 nm/ Em 560-610 nm;
标尺: 20 μm
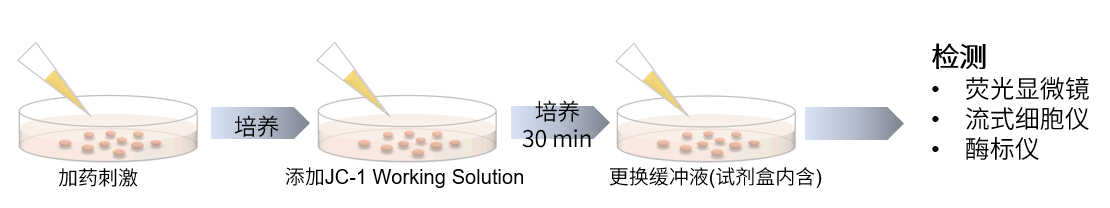
操作步骤
实验例
1.诱导凋亡的实验例
1.1 荧光显微镜
通过荧光颜色的改变判断由凋亡导致的线粒体膜电位的变化。
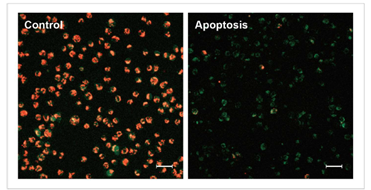
检测条件
Green: Ex 488 nm / Em 500-550 nm
Red : Ex 561 nm / Em 560-610 nm
标尺: 80 μm
1.2 流式细胞仪
定量分析单个细胞的膜电位变化
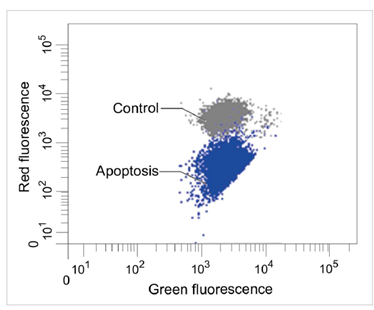
检测条件
Green: Ex 488 nm / Em 515-545 nm
Red : Ex 488 nm / Em 564-604 nm
1.3 酶标仪
确认孔板中吸光度来判断线粒体膜电位的变化
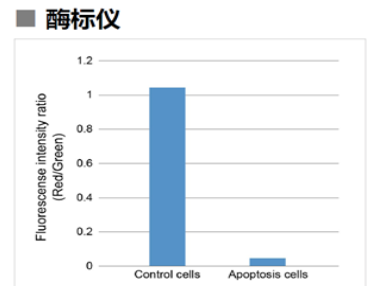
检测条件
Green: Ex 485 nm / Em 525-545 nm
Red : Ex 535 nm / Em 585-605 nm
2.诱导自噬的实验例
使用表达Parkin的HeLa细胞,分别使用线粒体自噬试剂盒(Mitophagy Detection Kit:MD01)和线粒体膜电位检测试剂盒(JC-1 MitoMP Detection Kit: MT09)来观察添加和不添加CCCP(羰基氰化物间氯苯)的线粒体状态的变化。
结果证明在未经CCCP处理的细胞中几乎未检测到线粒体自噬的发生,并且线粒体膜电位正常维持。 而在添加了CCCP的细胞中,证实了线粒体膜电位的降低(JC-1的红色荧光的降低)和线粒体的自噬(Mtphagy染料的荧光的增强)。
<检测条件>
线粒体自噬检测
Ex:561 nm,Em:570-700 nm
线粒体膜电位检测
绿色Ex:488 nm,Em:500-550 nm
红色Ex:561 nm,Em:560-610 nm
实验条件
1.将Parkin质粒导入HeLa细胞
使用HilyMax(货号:H357)将Parkin质粒引入HeLa细胞中(Parkin质粒/HilyMax试剂:0.1 μg/0.2 μl)
然后过夜培养,收集细胞进行以下检测。
2.自噬检测
向表达Parkin的HeLa细胞中添加0.1 μmol/l Mtphagy工作溶液,并在37°C下孵育30分钟。然后将细胞用HBSS洗涤,加入10 μg/ml CCCP/MEM溶液,并在37℃下孵育2小时。荧光显微镜下观察处理后的细胞。
3.线粒体膜电位检测
将10 μg/ml的CCCP/MEM溶液添加至表达Parkin的HeLa细胞中,并在37℃下孵育1.5小时。加入4 μmol/l的JC-1工作溶液使终浓度至2 μmol/l,并将细胞溶液在37℃下孵育30分钟。孵育后将细胞用HBSS洗涤,加入成像缓冲液,在荧光显微镜下观察细胞。
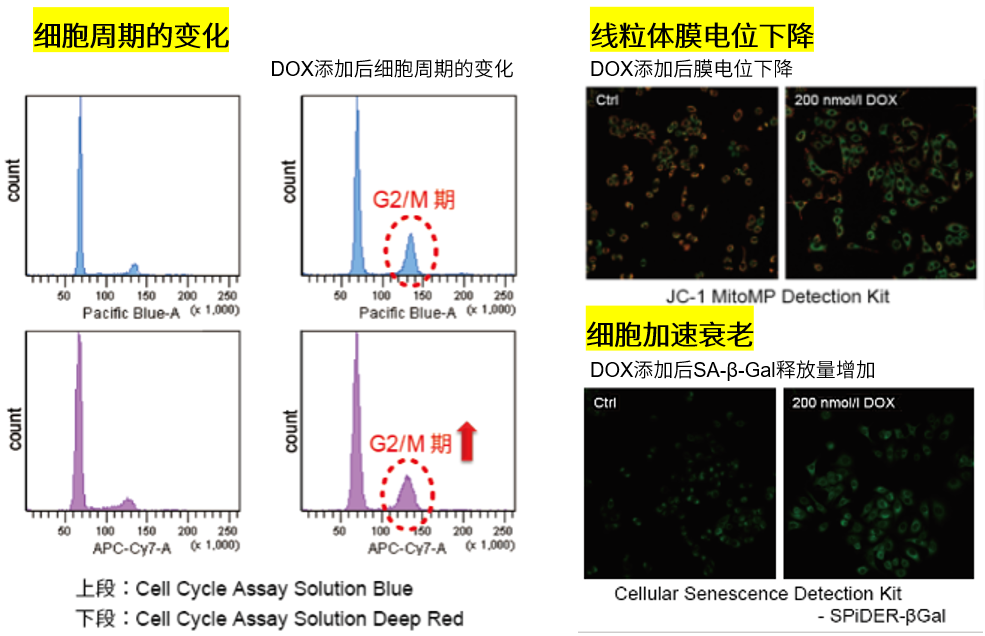
3.线粒体膜电位与细胞周期关联性
将已知能在细胞周期的G2/M期起作用以终止细胞增殖并诱导细胞衰老的阿霉素(DOX)加入A549细胞后,
使用细胞周期检测试剂盒蓝色(产品代码:C549)/深红色(产品代码:C548)后检测。
结果证实了A549细胞的细胞周期确实发生了变化,同时用细胞衰老检测试剂盒–SPiDER-βGal(产品代码:SG03)证实了细胞产生衰老,实验证实了线粒体膜电位会发生变化。
参考文献
| No. | Sample Type | Instrument | Reference |
| 1 | Cell:A549 | Microscope | K. Li, S. Sun, L. Xiao and Z. Zhang, “Bioactivity-guided fractionation of Helicteres angustifolia L. extract and its molecular evidence for tumor suppression”, Front Cell Dev Biol.,2023, doi: 10.3389/fcell.2023.1157172. |
| 2 | Cell:A549 | Flow Cytometer | C. N. D’Alessandro-Gabazza, T. Yasuma, T. Kobayashi, M. Toda1, A. M. Abdel-Hamid, H. Fujimoto, O. Hataji, H. Nakahara, A. Takeshita, K. Nishihama, T. Okano, H. Saiki, Y. Okano, A. Tomaru, V. F. D’Alessandro, M. Shiraishi, A. Mizoguchi, R. Ono, J. Ohtsuka, M. Fukumura, T. Nosaka, X. Mi, D. Shukla, K. Kataoka, Y. Kondoh, M. Hirose, T. Arai, Y. Inoue, Y. Yano, R. I. Mackie, I. Cann and E. C. Gabazza, “Inhibition of lung microbiota-derived proapoptotic peptides ameliorates acute exacerbation of pulmonary fibrosis”, Nat. Comm., 2022, doi:10.1038/s41467-022-29064-3. |
| 3 | Cell:A549, HeLa | Plate reader | J. Yang, L. Liu, Y. Oda, K. Wada, M. Ago, S. Matsuda, M. Hattori, T. Goto, Y. Kawashima, Y. Matsuzaki and T. Taketani,”Highly-purified rapidly expanding clones, RECs, are superior for functional-mitochondrial transfer”, Stem Cell Res Ther., 2023, doi: 10.1186/s13287-023-03274-y. |
| 4 | Cell:ALM | Plate reader | T. Nechiporuk, S.E. Kurtz, O. Nikolova, T. Liu, C.L. Jones, A. D. Alessandro, R. C. Hill, A. Almeida, S. K. Joshi, M. Rosenberg, C. E. Tognon, A. V. Danilov, B. J. Druker, B. H. Chang, S. K McWeeney and J. W. Tyner , “The TP53 Apoptotic Network Is a Primary Mediator of Resistance to BCL2 Inhibition in AML Cells.”, Cancer Discov, 2019, 9, |
| 5 | Cell:ARPE-19 | Flow Cytometer/ | J. Hamuro, T. Yamashita, Y. Otsuki, N. Hiramoto, M. Adachi, T. Miyatani, H. Tanaka, M. Ueno, S. Kinoshita and C. Sotozono,”Spatiotemporal Coordination of RPE Cell Quality by Extracellular Vesicle miR-494-3p Via Competitive Interplays With SIRT3 or PTEN”, Invest Ophthalmol Vis Sci., 2023, doi: 10.1167/iovs.64.5.9. |
| 6 | Cell:ARPE-19 | Microscope | J. H. Quan, F. F. Gao, H. A. Ismail, J. M. Yuk, G. H. Cha, J. Q. Chu and Y. H. Lee, “Silver Nanoparticle-Induced Apoptosis in ARPE-19 Cells Is Inhibited by Toxoplasma gondii Pre-Infection Through Suppression of NOX4-Dependent ROS Generation”, Int J Nanomedicine., 2020, 15, 3695–3716. |
| 7 | Cell:C2C12, myocytes | – | Z. Jing, T. Iba, H. Naito, P. Xu, J.I. Morishige, N. Nagata, H. Okubo and H.Ando ,”L-carnitine prevents lenvatinib-induced muscle toxicity without impairment of the anti-angiogenic efficacy”, Front Pharmacol., 2023, doi: 10.3389/fphar.2023.1182788. |
| 8 | Cell:C2C12, 3T3L1 | Plate reader | M. Kurano, K. Tsukamoto, T. Shimizu, H. Kassai, K. Nakao, A. Aiba, M. Hara and Yatomi , “Protection Against Insulin Resistance by Apolipoprotein M/Sphingosine 1-Phosphate “, Diabetes, 2020, DOI: 10.2337/db19-0811. |
| 9 | Cell:Colon 26 | Microscope | B. Uranbileg, M. Kurano, K. Kano, E. Sakai, J. Arita, K. Hasegawa, T. Nishikawa, S. Ishihara, H. Yamashita, Y. Seto, H. Ikeda, J. Aoki and Y. Yatomi,”Sphingosine 1‐phosphate lyase facilitates cancer progression through converting sphingolipids to glycerophospholipids”, Clin Transl Med., 2022, doi: 10.1002/ctm2.1056. |
| 10 | Tissue: Frozen heart slides |
Microscope | W. Yu, Y. Hu, Z. Liu, K. Guo, D. Ma, M. Peng, Y. Wang, J. Zhang, X. Zhang, P. Wang, J. Zhang, P. Liu and J. Lu,”Sorting nexin 3 exacerbates doxorubicin-induced cardiomyopathy via regulation of TFRC-dependent ferroptosis”, Acta Pharmaceutica Sinica B., 2023, doi: https://doi.org/10.1016/j.apsb.2023.08.016. |
| 11 | Cell:HCE | Microscope | T. Yamashita, K. Asada, M. Ueno, N. Hiramoto, T. Fujita, M. Toda, C. Sotozono, S. Kinoshita and J. Hamuro,”Cellular interplay through extracellular vesicle miR-184 alleviates corneal endothelium degeneration”, Ophthalmol Sci., 2022, doi: 10.1016/j.xops.2022.100212. |
| 12 | Cell:HCE | Microscope | M. Ueno, K Yoshii, T. Yamashita, K. Sonomura, K. Asada, E. Ito, T. Fujita, C. Sotozono, S. Kinoshita and J. Hamuro,”The Interplay Between Metabolites and MicroRNAs in Aqueous Humor to Coordinate Corneal Endothelium Integrity”, Ophthalmol Sci., 2023, doi: 10.1016/j.xops.2023.100299. |
| 13 | Cell:HCE-T | – | W. Otsu, T. Yako, E. Sugisawa, S. Nakamura, H. Tsusaki, N. Umigai, M. Shimazawa and H. Hara,”Crocetin protects against mitochondrial damage induced by UV-A irradiation in corneal epithelial cell line HCE-T cells”, J Pharmacol Sci., 2022, doi: 10.1016/j.jphs.2022.10.005. |
| 14 | Cell:HCE-T | Microscope | K. Ishida, T. Yako, M. Tanaka, W. Otsu, S. Nakamura, M. Shimazawa, H. Tsusaki and H. Hara,”Free-radical scavenger NSP-116 protects the corneal epithelium against UV-A and blue led light exposure”, Biol Pharm Bull., 2021, doi: 10.1248/bpb.b21-00017. |
| 15 | Cell:HepG | Microscope/Spectrophotometer | M. Ikura, K. Furuya, T. Matsuda and T. Ikura,”Impact of Nuclear De Novo NAD+ Synthesis via Histone Dynamics on DNA Repair during Cellular Senescence To Prevent Tumorigenesis”, Mol Cell Biol., 2022, doi: 10.1128/mcb.00379-22. |
| 16 | Cell:hiPSCs, Neurons | Microscope | T. Hara, M. Toyoshima, Y. Hisano, S. Balan, Y. Iwayama, H. Aono,Y. Futamura, H. Osada, Y. Owada and T. Yoshikawa,”Glyoxalase I disruption and external carbonyl stress impair mitochondrial function in human induced pluripotent stem cells and derived neurons”, Translational Psychiatry., 2021, doi: 10.1038/s41398-021-01392-w. |
| 17 | Cell:HSCs | Microscope | Y. Su, S. Lu, C. Hou, K. Ren, M. Wang, X. Liu, S. Zhao and X. Liu ,”Mitigation of liver fibrosis via hepatic stellate cells mitochondrial apoptosis induced by metformin”, International Immunopharmacology., 2022, doi: 10.1016/j.intimp.2022.108683. |
| 18 | Cell:HUVECs | Microscope | D. Ueno, K. Ikeda, E. Yamazaki, A. Katayama, R. Urata and S. Matoba ,”Spermidine improves angiogenic capacity of senescent endothelial cells, and enhances ischemia-induced neovascularization in aged mice”, Sci Rep., 2023, doi: 10.1038/s41598-023-35447-3. |
| 19 | Cell:KYSE30 | Microscope | Q. Luo, X. Wu, P. Zhao, Y. Nan, W. Chang, X. Zhu, D. Su and Z. Liu,”OTUD1 activates caspase‐independent and caspase‐dependent apoptosis by promoting AIF nuclear translocation and MCL1 degradation”, Adv Sci (Weinh)., 2021, doi: 10.1002/advs.202002874. |
| 20 | Cell: Macrophage | Microscope | G. Yang, M. Fan, J. Zhu, C. Ling, L. Wu, X. Zhang, M. Zhang, J. Li, Q. Yao, Z. Gu and X. Cai, “A multifunctional anti-inflammatory drug that can specifically target activated macrophages massively deplete intracellular H2O2 and produce large amounts CO for a highly efficient treatment of osreoarthritis” , Biomaterials, 2020, doi:10.1016/j.biomaterials.2020.120155. |
| 21 | Cell:MDA-MB-415, MCF-7 | Microscope | S.Y. Park, K.J. Jeong, A. Poire, D. Zhang, Y.H. Tsang, A.S. Blucher and G.B. Mills ,”Irreversible HER2 inhibitors overcome resistance to the RSL3 ferroptosis inducer in non-HER2 amplified luminal breast cancer”, Cell Death & Disease., 2023, doi: 10.1038/s41419-023-06042-1. |
| 22 | Cell:MIN6 | Plate reader/Microscope | N. Mizusawa, N. Harada, T. Iwata, I. Ohigashi, M. Itakura and K. Yoshimoto,”Identification of protease serine S1 family member 53 as a mitochondrial protein in murine islet beta cells”, Islets., 2022, doi: 10.1080/19382014.2021.1982325. |
| 23 | Cell:MSCs | Flow Cytometer | S.Y. Jo, H.J. Cho and T.M. Kim,”Fenoldopam mesylate enhances the survival of mesenchymal stem cells under oxidative stress and increases the therapeutic function in acute kidney injury”, Cell Transplant., 2023, doi: 10.1177/09636897221147920. |
| 24 | Cell:Neuro-2A | Microscope、Plate reader | Y. Wang, Y. Shinoda, A. Cheng, I. Kawahata and K. Fukunaga,”Epidermal fatty acid-binding protein 5 (FABP5) Involvement in alpha-synuclein-induced mitochondrial injury under oxidative stress”, Biomedicines., 2021, doi: 10.3390/biomedicines9020110. |
| 25 | Cell:Neuron | Microscope | I. Kawahata, L. Luc Bousset, R. Melki and K. Fukunaga , “Fatty Acid-Binding Protein 3 is Critical for α-Synuclein Uptake and MPP+-Induced Mitochondrial Dysfunction in Cultured Dopaminergic Neurons “, Int J Mol Sci., 2019, 20, 5358. |
| 26 | Cell:Neuron | Microscope | A. Fukuda, S. Nakashima,Y. Oda, K. Nishimura, H. Kawashima, H. Kimura, T. Ohgita, E. Kawashita, K. Ishihara, A. Hanaki, M. Okazaki, E. Matsuda, Y. Tanaka, S. Nakamura, T. Matsumoto, S. Akiba, H. Saito, H. Matsuda and K. Takata,”Plantainoside B in Bacopa monniera Binds to Aβ Aggregates Attenuating Neuronal Damage and Memory Deficits Induced by Aβ”, Biol Pharm Bull., 2023, doi: 10.1248/bpb.b22-00797. |
| 27 | Cell:PAECs | Plate reader | T. Sakai, H. Takagaki, N. Yamagiwa, M. Ui, S. Hatta and J. Imai,”Effects of the cytoplasm and mitochondrial specific hydroxyl radical scavengers TA293 and mitoTA293 in bleomycin-induced pulmonary fibrosis model mice”, Antioxidants (Basel)., 2021, doi: 10.3390/antiox10091398. |
| 28 | Cell:PANC-1 | Plate reader | W.A. Naime, A. Kimishima, A. Setiawan, J.R. Fahim, M.A. Fouad, M.S. Kamel and M. Arai,”Mitochondrial Targeting in an Anti-Austerity Approach Involving Bioactive Metabolites Isolated from the Marine-Derived Fungus Aspergillus sp.”, Marine drugs., 2020, doi: 10.3390/md18110555. |
| 29 | Cell:PANC-1, MIAPaca-2 | Microscope | T. Taniai, Y. Shirai,Y. Shimada, R. Hamura, M. Yanagaki, N. Takada, T. Horiuchi, K. Haruki, K. Furukawa, T. Uwagawa, K. Tsuboi, Y. Okamoto, S. Shimada, S. Tanaka, T. Ohashi and T. Ikegami,”Inhibition of acid ceramidase elicits mitochondrial dysfunction and oxidative stress in pancreatic cancer cells”, Cancer Sci., 2021, doi: 10.1111/cas.15123. |
| 30 | Cell:PC | Flow Cytometer | R. Hamura, Y. Shirai,Y. Shimada, N. Saito, T. Taniai, T. Horiuchi, N. Takada, Y. Kanegae, T. Ikegami, T. Ohashi and K. Yanaga ,”Suppression of lysosomal acid alpha‐glucosidase impacts the modulation of transcription factor EB translocation in pancreatic cancer”, Cancer Sci., 2021, doi: 10.1111/cas.14921. |
| 31 | Cell:Porcine oocytes | Microscope | W. Hu, Y. Zhang, D. Wang, T. Yang, J. Qi, Y. Zhang, H. Jiang, J Zhang, B. Sun and S. Liang,”Iron Overload-Induced Ferroptosis Impairs Porcine Oocyte Maturation and Subsequent Embryonic Developmental Competence in vitro”, Front Cell Dev Biol., 2021, doi: 10.3389/fcell.2021.673291. |
| 32 | Cell:Porcine oocytes | Microscope | Y. Xiao, B. Yuan, W. Hu, J. Qi, H. Jiang, B. Sun, J. Zhang and S. Liang,”Tributyltin Oxide Exposure During in vitro Maturation Disrupts Oocyte Maturation and Subsequent Embryonic Developmental Competence in Pigs”, Front Cell Dev Biol., 2021, doi: 10.3389/fcell.2021.683448. |
| 33 | Cell:RGC-5 | Plate reader | Y. Aoyama, S. Inagaki, K. Aoshima, Y. Iwata, S. Nakamura, H. Hara and M. Shimazawa,”Involvement of endoplasmic reticulum stress in rotenone-induced leber hereditary optic neuropathy model and the discovery of new therapeutic agents”, J Pharmacol Sci . .,2021, doi: 10.1016/j.jphs.2021.07.003. |
| 34 | Cell:SAS,HSC-2 | Plate reader | K. Yamana, J. Inoue, R. Yoshida, J. Sakata, H. Nakashima, H. Arita, S. Kawaguchi, S. Gohara, Y. Nagao, H. Takeshita, M. Maeshiro, R. Liu, Y. Matsuoka, M. Hirayama, K. Kawahara, M. Nagata, A. Hirosue, R. Toya, R. Murakami, Y. Kuwahara, M. Fukumoto and H. Nakayama,”Extracellular vesicles derived from radioresistant oral squamous cell carcinoma cells contribute to the acquisition of radioresistance via the miR‐503‐3p‐BAK axis”, J Extracell Vesicles., 2021, doi: 10.1002/jev2.12169. |
| 35 | Cell:SBC-3 | Flow Cytometer | N. Takahashi, T. Iguchi, M. Kuroda, M. Mishima and Y. Mimaki,”Novel Oleanane-Type Triterpene Glycosides from the Saponaria officinalis L. Seeds and Apoptosis-Inducing Activity via Mitochondria”, Int J Mol Sci., 2022, doi: 10.3390/ijms23042047. |
| 36 | Cell:SH-SY5Y | Microscope | Q. Guo, I. Kawahata, A. Cheng, H. Wang, W. Jia, H. Yoshino and K. Fukunaga,”Fatty acid-binding proteins 3 and 5 are involved in the initiation of mitochondrial damage in ischemic neurons”, Redox Biology., 2023, doi: 10.1016/j.redox.2022.102547. |
| 37 | Cell:SiHa | Microscope | F.F. Gao, J.H. Quan, M.A. Lee, W. Ye, J.M. Yuk, G.H. Cha, I.W. Choi and Y.H. Lee,”Trichomonas vaginalis induces apoptosis via ROS and ER stress response through ER–mitochondria crosstalk in SiHa cells”, Parasites &vectors., 2021, doi: 10.1186/s13071-021-05098-2. |
| 38 | Cell:SU-DHL-2 | Flow Cytometer | Q. Zhao, D. Jiang, X. Sun, Q. Mo, S. Chen, W. Chen, R. Gui and X. Ma,”Biomimetic nanotherapy: core–shell structured nanocomplexes based on the neutrophil membrane for targeted therapy of lymphoma”, J Nanobiotechnology., 2021, doi: 10.1186/s12951-021-00922-4. |
| 39 | Cell:THP-1 | Microscope | W. Zheng, Z. Zhou, Y. Rui, R. Ye, F. Xia, F. Guo, X. Liu, J. Su, M. Lou, and X.F. Yu,”TRAF3 activates STING-mediated suppression of EV-A71 and target of viral evasion”, Signal Transduct Target Ther., 2023, doi: 10.1038/s41392-022-01287-2. |
| 40 | Cell:TSM15 | In Cell Analyzer | M. Honda, F. Shimizu, R. Sato, Y. Mizukami, K. Watanabe, Y. Takeshita, T. Maeda, M. Koga and T. Kanda,”Jo-1 Antibodies From Myositis Induce Complement-Dependent Cytotoxicity and TREM-1 Upregulation in Muscle Endothelial Cells”, Neurol Neuroimmunol Neuroinflamm., 2023, doi: 10.1212/NXI.0000000000200116. |
| 41 | Cell:tumor | Flow Cytometer | H. Wang, X. Rong, G. Zhao, Y. Zhou, Y. Xiao, D. Ma, X. Jin, Y. Wu, Y. Yan, H. Yang, Y. Zhou, M. Qian, C. Niu, X. Hu, D.Q. Li, Q. Liu, Y. Wen, Y.Z. Jiang, C. Zhao and Z.M. Shao ,”The microbial metabolite trimethylamine N-oxide promotes antitumor immunity in triple-negative breast cancer”, Cell Metab., 2022, doi: 10.1016/j.cmet.2022.02.010. |
| 42 | Cell:TY10 | In Cell Analyzer | F. Shimizu, R. Ogawa, Y. Mizukami, K. Watanabe, K. Hara, C. Kadono, T. Takahashi, T. Misu, Y. Takeshita, Y. Sano, M. Fujisawa, T. Maeda, I. Nakashima, K. Fujihara and T. Kanda,”GRP78 antibodies are associated with blood-brain barrier breakdown in anti–myelin oligodendrocyte glycoprotein antibody–associated disorder”, Neurol Neuroimmunol Neuroinflamm., 2022, doi: 10.1212/NXI.0000000000001038. |
| 43 | Cell:U2OS, HeLa | Microscope | T. Namba, “BAP31 regulates mitochondrial function via interaction with Tom40 within ER-mitochondria contact sites “, Sci Adv., 2019, 5, (6), 1386. |
常见问题Q&A
| Q1: 本试剂盒可以检测多少次? |
| A1:大概的使用次数请参考下表: |
| 检测装置 | 容器 | 使用次数 | 液量 |
| 流式细胞仪 | – | 100次 | 0.5 ml/次 |
| 荧光显微镜 荧光酶标仪 |
35 mm dish | 25块板 | 2 ml/孔 |
| 8孔Chamber Slide | 30块板 | 200 μl/孔 | |
| 96孔板 | 5块板 | 100 μl/孔 |
| Q2:在JC-1染色后,可以使用PBS代替HBSS洗涤吗? |
| A2:我们建议使用HBSS来减少对细胞的损伤。如果您手边没有HBSS的话,建议使用培养基洗净。 |
| Q3:可以使用含血清的培养基吗? |
| A3:在清洗细胞和Working Solution中可以使用含血清的培养基。在观察荧光时建议使用Imaging Buffer。如果一定要使用含血清的培养基的话,建议不要加酚红。 |
| Q4:染色后细胞固定或者固定后进行染色可以实现吗? |
| A4:细胞固定操作会使得线粒体去极化,所以染色前后均不能进行细胞固定。 |
|
Q5:处理后的样品与对照组相比较,红和绿两种荧光值都增加(或减少)了,结果该如何解释? |
| A5:请先比较实验组和对照组的荧光比值,两者相比,荧光比越低,线粒体膜电位越低。
用荧光之比进行结果分析的理由。 JC-1由于膜电位依存性地在细胞中积蓄,根据细胞的状态,每个细胞的JC-1的浓度有可能不同。 由于对照组和实验组处理样品的细胞状态不同,JC-1的累积浓度不同。) 另外,在线粒体膜电位较高的状态下,JC-1会聚集在一起,使荧光从绿色转移到红色。 该聚集体的量取决于膜电位的程度,因此可以用红/绿之比来比较样品之间的线粒体膜电位。 <参考文献> 1) Cossarizza, A. et al., Biochem Biophys Res Commun., 1993, 197(1), 40. 2) Perelman, A. et al., Cell Death and Disease, 2012, 3, e430 3) Smiley, S. T. et al., Proc. Nail. Acad. Sci., 1991, 88, 3671. |
关联产品




上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
特点:
● 灵敏度高
● 易上手
● 多种仪器均可检测


产品解说
活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Cell Counting Kit-8 细胞增殖毒性检测
NO.2. ROS Assay Kit 活性氧检测
NO.3. FerroOrange 细胞亚铁离子检测
NO.4. GSSG/GSH Quantification Kit II 氧化型/还原型谷胱甘肽
NO.5. Mitophagy Detection Kit 线粒体自噬检测
试剂盒内含

产品概述
细胞中的线粒体作为有氧呼吸产生ATP的主要场所,是体内重要的细胞器之一,常被用于早期细胞毒性、氧化应激、细胞凋亡等研究中1)。线粒体活性的降低与机能失调,已被证实与癌症、衰老、神经退行性疾病 (如阿尔兹海默症、帕金森病等) 等密切相关2)3)。
JC-1是一种被广泛使用的小分子线粒体膜电位探针,依赖于线粒体膜电位在线粒体中聚集,染料伴随聚集过程,荧光从绿色 (530 nm) 变为红色 (590 nm)。当线粒体发生去极化,红/绿荧光强度比值降低。以往的研究者反映,JC-1不易溶于水并有大量沉淀产生。但与其他公司的产品不同,同仁化学研究所研制的JC-1试剂解决了这一问题,避免了沉淀的产生。同时使用试剂盒中配制的成像缓冲液 (Imaging Buffer),可大幅降低荧光背景并在检测过程中保护细胞不受损伤。
当JC-1工作液的浓度为2 μmol/l, 每次用量为100 μl时,可以检测500次。
产品特点
1.为什么要检测线粒体膜电位
线粒体不仅是细胞内产生能量的场所,它还与癌症、衰老、阿尔兹海默症、帕金森等神经变异性疾病密切相关。因此,针对线粒体状态的研究非常重要,其中线粒体膜电位的变化经常被作为重要的指标之一检测。
当线粒体正常、膜电位差保持不变时,JC-1会聚集并发出红色荧光,而当膜电位降低时,JC-1会作为单体存在并发出绿色荧光。红色和绿色荧光强度的变化可以作为检测线粒体状态的指标。

2.初次使用也很容易上手

3.去极化的检测实例
使用去极化剂carbonylcyanide-p-trifluoromethoxyphenylhydrazone(FCCP)对HeLa细胞进行处理,用本试
剂盒进行检测。可以发现与未加药物的细胞相比,加药组细胞的红色荧光明显减少。

实验条件
JC-1浓度: 2 μmol/l in MEM, 染色时间30 min
FCCP浓度:100 μmol/l, FCCP处理时间1 h
检测条件
Green : Ex 488 nm/ Em 500-550 nm;
Red : Ex 561 nm/ Em 560-610 nm;
标尺: 20 μm
操作步骤

实验例
1.诱导凋亡的实验例
1.1 荧光显微镜
通过荧光颜色的改变判断由凋亡导致的线粒体膜电位的变化。

检测条件
Green: Ex 488 nm / Em 500-550 nm
Red : Ex 561 nm / Em 560-610 nm
标尺: 80 μm
1.2 流式细胞仪
定量分析单个细胞的膜电位变化

检测条件
Green: Ex 488 nm / Em 515-545 nm
Red : Ex 488 nm / Em 564-604 nm
1.3 酶标仪
确认孔板中吸光度来判断线粒体膜电位的变化

检测条件
Green: Ex 485 nm / Em 525-545 nm
Red : Ex 535 nm / Em 585-605 nm
2.诱导自噬的实验例
使用表达Parkin的HeLa细胞,分别使用线粒体自噬试剂盒(Mitophagy Detection Kit:MD01)和线粒体膜电位检测试剂盒(JC-1 MitoMP Detection Kit: MT09)来观察添加和不添加CCCP(羰基氰化物间氯苯)的线粒体状态的变化。
结果证明在未经CCCP处理的细胞中几乎未检测到线粒体自噬的发生,并且线粒体膜电位正常维持。 而在添加了CCCP的细胞中,证实了线粒体膜电位的降低(JC-1的红色荧光的降低)和线粒体的自噬(Mtphagy染料的荧光的增强)。
<检测条件>
线粒体自噬检测
Ex:561 nm,Em:570-700 nm
线粒体膜电位检测
绿色Ex:488 nm,Em:500-550 nm
红色Ex:561 nm,Em:560-610 nm
实验条件
1.将Parkin质粒导入HeLa细胞
使用HilyMax(货号:H357)将Parkin质粒引入HeLa细胞中(Parkin质粒/HilyMax试剂:0.1 μg/0.2 μl)
然后过夜培养,收集细胞进行以下检测。
2.自噬检测
向表达Parkin的HeLa细胞中添加0.1 μmol/l Mtphagy工作溶液,并在37°C下孵育30分钟。然后将细胞用HBSS洗涤,加入10 μg/ml CCCP/MEM溶液,并在37℃下孵育2小时。荧光显微镜下观察处理后的细胞。
3.线粒体膜电位检测
将10 μg/ml的CCCP/MEM溶液添加至表达Parkin的HeLa细胞中,并在37℃下孵育1.5小时。加入4 μmol/l的JC-1工作溶液使终浓度至2 μmol/l,并将细胞溶液在37℃下孵育30分钟。孵育后将细胞用HBSS洗涤,加入成像缓冲液,在荧光显微镜下观察细胞。

3.线粒体膜电位与细胞周期关联性
将已知能在细胞周期的G2/M期起作用以终止细胞增殖并诱导细胞衰老的阿霉素(DOX)加入A549细胞后,
使用细胞周期检测试剂盒蓝色(产品代码:C549)/深红色(产品代码:C548)后检测。
结果证实了A549细胞的细胞周期确实发生了变化,同时用细胞衰老检测试剂盒–SPiDER-βGal(产品代码:SG03)证实了细胞产生衰老,实验证实了线粒体膜电位会发生变化。


参考文献
| No. | Sample Type | Instrument | Reference |
| 1 | Cell:A549 | Microscope | K. Li, S. Sun, L. Xiao and Z. Zhang, “Bioactivity-guided fractionation of Helicteres angustifolia L. extract and its molecular evidence for tumor suppression”, Front Cell Dev Biol.,2023, doi: 10.3389/fcell.2023.1157172. |
| 2 | Cell:A549 | Flow Cytometer | C. N. D’Alessandro-Gabazza, T. Yasuma, T. Kobayashi, M. Toda1, A. M. Abdel-Hamid, H. Fujimoto, O. Hataji, H. Nakahara, A. Takeshita, K. Nishihama, T. Okano, H. Saiki, Y. Okano, A. Tomaru, V. F. D’Alessandro, M. Shiraishi, A. Mizoguchi, R. Ono, J. Ohtsuka, M. Fukumura, T. Nosaka, X. Mi, D. Shukla, K. Kataoka, Y. Kondoh, M. Hirose, T. Arai, Y. Inoue, Y. Yano, R. I. Mackie, I. Cann and E. C. Gabazza, “Inhibition of lung microbiota-derived proapoptotic peptides ameliorates acute exacerbation of pulmonary fibrosis”, Nat. Comm., 2022, doi:10.1038/s41467-022-29064-3. |
| 3 | Cell:A549, HeLa | Plate reader | J. Yang, L. Liu, Y. Oda, K. Wada, M. Ago, S. Matsuda, M. Hattori, T. Goto, Y. Kawashima, Y. Matsuzaki and T. Taketani,”Highly-purified rapidly expanding clones, RECs, are superior for functional-mitochondrial transfer”, Stem Cell Res Ther., 2023, doi: 10.1186/s13287-023-03274-y. |
| 4 | Cell:ALM | Plate reader | T. Nechiporuk, S.E. Kurtz, O. Nikolova, T. Liu, C.L. Jones, A. D. Alessandro, R. C. Hill, A. Almeida, S. K. Joshi, M. Rosenberg, C. E. Tognon, A. V. Danilov, B. J. Druker, B. H. Chang, S. K McWeeney and J. W. Tyner , “The TP53 Apoptotic Network Is a Primary Mediator of Resistance to BCL2 Inhibition in AML Cells.”, Cancer Discov, 2019, 9, |
| 5 | Cell:ARPE-19 | Flow Cytometer/ | J. Hamuro, T. Yamashita, Y. Otsuki, N. Hiramoto, M. Adachi, T. Miyatani, H. Tanaka, M. Ueno, S. Kinoshita and C. Sotozono,”Spatiotemporal Coordination of RPE Cell Quality by Extracellular Vesicle miR-494-3p Via Competitive Interplays With SIRT3 or PTEN”, Invest Ophthalmol Vis Sci., 2023, doi: 10.1167/iovs.64.5.9. |
| 6 | Cell:ARPE-19 | Microscope | J. H. Quan, F. F. Gao, H. A. Ismail, J. M. Yuk, G. H. Cha, J. Q. Chu and Y. H. Lee, “Silver Nanoparticle-Induced Apoptosis in ARPE-19 Cells Is Inhibited by Toxoplasma gondii Pre-Infection Through Suppression of NOX4-Dependent ROS Generation”, Int J Nanomedicine., 2020, 15, 3695–3716. |
| 7 | Cell:C2C12, myocytes | – | Z. Jing, T. Iba, H. Naito, P. Xu, J.I. Morishige, N. Nagata, H. Okubo and H.Ando ,”L-carnitine prevents lenvatinib-induced muscle toxicity without impairment of the anti-angiogenic efficacy”, Front Pharmacol., 2023, doi: 10.3389/fphar.2023.1182788. |
| 8 | Cell:C2C12, 3T3L1 | Plate reader | M. Kurano, K. Tsukamoto, T. Shimizu, H. Kassai, K. Nakao, A. Aiba, M. Hara and Yatomi , “Protection Against Insulin Resistance by Apolipoprotein M/Sphingosine 1-Phosphate “, Diabetes, 2020, DOI: 10.2337/db19-0811. |
| 9 | Cell:Colon 26 | Microscope | B. Uranbileg, M. Kurano, K. Kano, E. Sakai, J. Arita, K. Hasegawa, T. Nishikawa, S. Ishihara, H. Yamashita, Y. Seto, H. Ikeda, J. Aoki and Y. Yatomi,”Sphingosine 1‐phosphate lyase facilitates cancer progression through converting sphingolipids to glycerophospholipids”, Clin Transl Med., 2022, doi: 10.1002/ctm2.1056. |
| 10 | Tissue: Frozen heart slides |
Microscope | W. Yu, Y. Hu, Z. Liu, K. Guo, D. Ma, M. Peng, Y. Wang, J. Zhang, X. Zhang, P. Wang, J. Zhang, P. Liu and J. Lu,”Sorting nexin 3 exacerbates doxorubicin-induced cardiomyopathy via regulation of TFRC-dependent ferroptosis”, Acta Pharmaceutica Sinica B., 2023, doi: https://doi.org/10.1016/j.apsb.2023.08.016. |
| 11 | Cell:HCE | Microscope | T. Yamashita, K. Asada, M. Ueno, N. Hiramoto, T. Fujita, M. Toda, C. Sotozono, S. Kinoshita and J. Hamuro,”Cellular interplay through extracellular vesicle miR-184 alleviates corneal endothelium degeneration”, Ophthalmol Sci., 2022, doi: 10.1016/j.xops.2022.100212. |
| 12 | Cell:HCE | Microscope | M. Ueno, K Yoshii, T. Yamashita, K. Sonomura, K. Asada, E. Ito, T. Fujita, C. Sotozono, S. Kinoshita and J. Hamuro,”The Interplay Between Metabolites and MicroRNAs in Aqueous Humor to Coordinate Corneal Endothelium Integrity”, Ophthalmol Sci., 2023, doi: 10.1016/j.xops.2023.100299. |
| 13 | Cell:HCE-T | – | W. Otsu, T. Yako, E. Sugisawa, S. Nakamura, H. Tsusaki, N. Umigai, M. Shimazawa and H. Hara,”Crocetin protects against mitochondrial damage induced by UV-A irradiation in corneal epithelial cell line HCE-T cells”, J Pharmacol Sci., 2022, doi: 10.1016/j.jphs.2022.10.005. |
| 14 | Cell:HCE-T | Microscope | K. Ishida, T. Yako, M. Tanaka, W. Otsu, S. Nakamura, M. Shimazawa, H. Tsusaki and H. Hara,”Free-radical scavenger NSP-116 protects the corneal epithelium against UV-A and blue led light exposure”, Biol Pharm Bull., 2021, doi: 10.1248/bpb.b21-00017. |
| 15 | Cell:HepG | Microscope/Spectrophotometer | M. Ikura, K. Furuya, T. Matsuda and T. Ikura,”Impact of Nuclear De Novo NAD+ Synthesis via Histone Dynamics on DNA Repair during Cellular Senescence To Prevent Tumorigenesis”, Mol Cell Biol., 2022, doi: 10.1128/mcb.00379-22. |
| 16 | Cell:hiPSCs, Neurons | Microscope | T. Hara, M. Toyoshima, Y. Hisano, S. Balan, Y. Iwayama, H. Aono,Y. Futamura, H. Osada, Y. Owada and T. Yoshikawa,”Glyoxalase I disruption and external carbonyl stress impair mitochondrial function in human induced pluripotent stem cells and derived neurons”, Translational Psychiatry., 2021, doi: 10.1038/s41398-021-01392-w. |
| 17 | Cell:HSCs | Microscope | Y. Su, S. Lu, C. Hou, K. Ren, M. Wang, X. Liu, S. Zhao and X. Liu ,”Mitigation of liver fibrosis via hepatic stellate cells mitochondrial apoptosis induced by metformin”, International Immunopharmacology., 2022, doi: 10.1016/j.intimp.2022.108683. |
| 18 | Cell:HUVECs | Microscope | D. Ueno, K. Ikeda, E. Yamazaki, A. Katayama, R. Urata and S. Matoba ,”Spermidine improves angiogenic capacity of senescent endothelial cells, and enhances ischemia-induced neovascularization in aged mice”, Sci Rep., 2023, doi: 10.1038/s41598-023-35447-3. |
| 19 | Cell:KYSE30 | Microscope | Q. Luo, X. Wu, P. Zhao, Y. Nan, W. Chang, X. Zhu, D. Su and Z. Liu,”OTUD1 activates caspase‐independent and caspase‐dependent apoptosis by promoting AIF nuclear translocation and MCL1 degradation”, Adv Sci (Weinh)., 2021, doi: 10.1002/advs.202002874. |
| 20 | Cell: Macrophage | Microscope | G. Yang, M. Fan, J. Zhu, C. Ling, L. Wu, X. Zhang, M. Zhang, J. Li, Q. Yao, Z. Gu and X. Cai, “A multifunctional anti-inflammatory drug that can specifically target activated macrophages massively deplete intracellular H2O2 and produce large amounts CO for a highly efficient treatment of osreoarthritis” , Biomaterials, 2020, doi:10.1016/j.biomaterials.2020.120155. |
| 21 | Cell:MDA-MB-415, MCF-7 | Microscope | S.Y. Park, K.J. Jeong, A. Poire, D. Zhang, Y.H. Tsang, A.S. Blucher and G.B. Mills ,”Irreversible HER2 inhibitors overcome resistance to the RSL3 ferroptosis inducer in non-HER2 amplified luminal breast cancer”, Cell Death & Disease., 2023, doi: 10.1038/s41419-023-06042-1. |
| 22 | Cell:MIN6 | Plate reader/Microscope | N. Mizusawa, N. Harada, T. Iwata, I. Ohigashi, M. Itakura and K. Yoshimoto,”Identification of protease serine S1 family member 53 as a mitochondrial protein in murine islet beta cells”, Islets., 2022, doi: 10.1080/19382014.2021.1982325. |
| 23 | Cell:MSCs | Flow Cytometer | S.Y. Jo, H.J. Cho and T.M. Kim,”Fenoldopam mesylate enhances the survival of mesenchymal stem cells under oxidative stress and increases the therapeutic function in acute kidney injury”, Cell Transplant., 2023, doi: 10.1177/09636897221147920. |
| 24 | Cell:Neuro-2A | Microscope、Plate reader | Y. Wang, Y. Shinoda, A. Cheng, I. Kawahata and K. Fukunaga,”Epidermal fatty acid-binding protein 5 (FABP5) Involvement in alpha-synuclein-induced mitochondrial injury under oxidative stress”, Biomedicines., 2021, doi: 10.3390/biomedicines9020110. |
| 25 | Cell:Neuron | Microscope | I. Kawahata, L. Luc Bousset, R. Melki and K. Fukunaga , “Fatty Acid-Binding Protein 3 is Critical for α-Synuclein Uptake and MPP+-Induced Mitochondrial Dysfunction in Cultured Dopaminergic Neurons “, Int J Mol Sci., 2019, 20, 5358. |
| 26 | Cell:Neuron | Microscope | A. Fukuda, S. Nakashima,Y. Oda, K. Nishimura, H. Kawashima, H. Kimura, T. Ohgita, E. Kawashita, K. Ishihara, A. Hanaki, M. Okazaki, E. Matsuda, Y. Tanaka, S. Nakamura, T. Matsumoto, S. Akiba, H. Saito, H. Matsuda and K. Takata,”Plantainoside B in Bacopa monniera Binds to Aβ Aggregates Attenuating Neuronal Damage and Memory Deficits Induced by Aβ”, Biol Pharm Bull., 2023, doi: 10.1248/bpb.b22-00797. |
| 27 | Cell:PAECs | Plate reader | T. Sakai, H. Takagaki, N. Yamagiwa, M. Ui, S. Hatta and J. Imai,”Effects of the cytoplasm and mitochondrial specific hydroxyl radical scavengers TA293 and mitoTA293 in bleomycin-induced pulmonary fibrosis model mice”, Antioxidants (Basel)., 2021, doi: 10.3390/antiox10091398. |
| 28 | Cell:PANC-1 | Plate reader | W.A. Naime, A. Kimishima, A. Setiawan, J.R. Fahim, M.A. Fouad, M.S. Kamel and M. Arai,”Mitochondrial Targeting in an Anti-Austerity Approach Involving Bioactive Metabolites Isolated from the Marine-Derived Fungus Aspergillus sp.”, Marine drugs., 2020, doi: 10.3390/md18110555. |
| 29 | Cell:PANC-1, MIAPaca-2 | Microscope | T. Taniai, Y. Shirai,Y. Shimada, R. Hamura, M. Yanagaki, N. Takada, T. Horiuchi, K. Haruki, K. Furukawa, T. Uwagawa, K. Tsuboi, Y. Okamoto, S. Shimada, S. Tanaka, T. Ohashi and T. Ikegami,”Inhibition of acid ceramidase elicits mitochondrial dysfunction and oxidative stress in pancreatic cancer cells”, Cancer Sci., 2021, doi: 10.1111/cas.15123. |
| 30 | Cell:PC | Flow Cytometer | R. Hamura, Y. Shirai,Y. Shimada, N. Saito, T. Taniai, T. Horiuchi, N. Takada, Y. Kanegae, T. Ikegami, T. Ohashi and K. Yanaga ,”Suppression of lysosomal acid alpha‐glucosidase impacts the modulation of transcription factor EB translocation in pancreatic cancer”, Cancer Sci., 2021, doi: 10.1111/cas.14921. |
| 31 | Cell:Porcine oocytes | Microscope | W. Hu, Y. Zhang, D. Wang, T. Yang, J. Qi, Y. Zhang, H. Jiang, J Zhang, B. Sun and S. Liang,”Iron Overload-Induced Ferroptosis Impairs Porcine Oocyte Maturation and Subsequent Embryonic Developmental Competence in vitro”, Front Cell Dev Biol., 2021, doi: 10.3389/fcell.2021.673291. |
| 32 | Cell:Porcine oocytes | Microscope | Y. Xiao, B. Yuan, W. Hu, J. Qi, H. Jiang, B. Sun, J. Zhang and S. Liang,”Tributyltin Oxide Exposure During in vitro Maturation Disrupts Oocyte Maturation and Subsequent Embryonic Developmental Competence in Pigs”, Front Cell Dev Biol., 2021, doi: 10.3389/fcell.2021.683448. |
| 33 | Cell:RGC-5 | Plate reader | Y. Aoyama, S. Inagaki, K. Aoshima, Y. Iwata, S. Nakamura, H. Hara and M. Shimazawa,”Involvement of endoplasmic reticulum stress in rotenone-induced leber hereditary optic neuropathy model and the discovery of new therapeutic agents”, J Pharmacol Sci . .,2021, doi: 10.1016/j.jphs.2021.07.003. |
| 34 | Cell:SAS,HSC-2 | Plate reader | K. Yamana, J. Inoue, R. Yoshida, J. Sakata, H. Nakashima, H. Arita, S. Kawaguchi, S. Gohara, Y. Nagao, H. Takeshita, M. Maeshiro, R. Liu, Y. Matsuoka, M. Hirayama, K. Kawahara, M. Nagata, A. Hirosue, R. Toya, R. Murakami, Y. Kuwahara, M. Fukumoto and H. Nakayama,”Extracellular vesicles derived from radioresistant oral squamous cell carcinoma cells contribute to the acquisition of radioresistance via the miR‐503‐3p‐BAK axis”, J Extracell Vesicles., 2021, doi: 10.1002/jev2.12169. |
| 35 | Cell:SBC-3 | Flow Cytometer | N. Takahashi, T. Iguchi, M. Kuroda, M. Mishima and Y. Mimaki,”Novel Oleanane-Type Triterpene Glycosides from the Saponaria officinalis L. Seeds and Apoptosis-Inducing Activity via Mitochondria”, Int J Mol Sci., 2022, doi: 10.3390/ijms23042047. |
| 36 | Cell:SH-SY5Y | Microscope | Q. Guo, I. Kawahata, A. Cheng, H. Wang, W. Jia, H. Yoshino and K. Fukunaga,”Fatty acid-binding proteins 3 and 5 are involved in the initiation of mitochondrial damage in ischemic neurons”, Redox Biology., 2023, doi: 10.1016/j.redox.2022.102547. |
| 37 | Cell:SiHa | Microscope | F.F. Gao, J.H. Quan, M.A. Lee, W. Ye, J.M. Yuk, G.H. Cha, I.W. Choi and Y.H. Lee,”Trichomonas vaginalis induces apoptosis via ROS and ER stress response through ER–mitochondria crosstalk in SiHa cells”, Parasites &vectors., 2021, doi: 10.1186/s13071-021-05098-2. |
| 38 | Cell:SU-DHL-2 | Flow Cytometer | Q. Zhao, D. Jiang, X. Sun, Q. Mo, S. Chen, W. Chen, R. Gui and X. Ma,”Biomimetic nanotherapy: core–shell structured nanocomplexes based on the neutrophil membrane for targeted therapy of lymphoma”, J Nanobiotechnology., 2021, doi: 10.1186/s12951-021-00922-4. |
| 39 | Cell:THP-1 | Microscope | W. Zheng, Z. Zhou, Y. Rui, R. Ye, F. Xia, F. Guo, X. Liu, J. Su, M. Lou, and X.F. Yu,”TRAF3 activates STING-mediated suppression of EV-A71 and target of viral evasion”, Signal Transduct Target Ther., 2023, doi: 10.1038/s41392-022-01287-2. |
| 40 | Cell:TSM15 | In Cell Analyzer | M. Honda, F. Shimizu, R. Sato, Y. Mizukami, K. Watanabe, Y. Takeshita, T. Maeda, M. Koga and T. Kanda,”Jo-1 Antibodies From Myositis Induce Complement-Dependent Cytotoxicity and TREM-1 Upregulation in Muscle Endothelial Cells”, Neurol Neuroimmunol Neuroinflamm., 2023, doi: 10.1212/NXI.0000000000200116. |
| 41 | Cell:tumor | Flow Cytometer | H. Wang, X. Rong, G. Zhao, Y. Zhou, Y. Xiao, D. Ma, X. Jin, Y. Wu, Y. Yan, H. Yang, Y. Zhou, M. Qian, C. Niu, X. Hu, D.Q. Li, Q. Liu, Y. Wen, Y.Z. Jiang, C. Zhao and Z.M. Shao ,”The microbial metabolite trimethylamine N-oxide promotes antitumor immunity in triple-negative breast cancer”, Cell Metab., 2022, doi: 10.1016/j.cmet.2022.02.010. |
| 42 | Cell:TY10 | In Cell Analyzer | F. Shimizu, R. Ogawa, Y. Mizukami, K. Watanabe, K. Hara, C. Kadono, T. Takahashi, T. Misu, Y. Takeshita, Y. Sano, M. Fujisawa, T. Maeda, I. Nakashima, K. Fujihara and T. Kanda,”GRP78 antibodies are associated with blood-brain barrier breakdown in anti–myelin oligodendrocyte glycoprotein antibody–associated disorder”, Neurol Neuroimmunol Neuroinflamm., 2022, doi: 10.1212/NXI.0000000000001038. |
| 43 | Cell:U2OS, HeLa | Microscope | T. Namba, “BAP31 regulates mitochondrial function via interaction with Tom40 within ER-mitochondria contact sites “, Sci Adv., 2019, 5, (6), 1386. |
常见问题Q&A
| Q1: 本试剂盒可以检测多少次? |
| A1:大概的使用次数请参考下表: |
| 检测装置 | 容器 | 使用次数 | 液量 |
| 流式细胞仪 | – | 100次 | 0.5 ml/次 |
| 荧光显微镜 荧光酶标仪 |
35 mm dish | 25块板 | 2 ml/孔 |
| 8孔Chamber Slide | 30块板 | 200 μl/孔 | |
| 96孔板 | 5块板 | 100 μl/孔 |
| Q2:在JC-1染色后,可以使用PBS代替HBSS洗涤吗? |
| A2:我们建议使用HBSS来减少对细胞的损伤。如果您手边没有HBSS的话,建议使用培养基洗净。 |
| Q3:可以使用含血清的培养基吗? |
| A3:在清洗细胞和Working Solution中可以使用含血清的培养基。在观察荧光时建议使用Imaging Buffer。如果一定要使用含血清的培养基的话,建议不要加酚红。 |
| Q4:染色后细胞固定或者固定后进行染色可以实现吗? |
| A4:细胞固定操作会使得线粒体去极化,所以染色前后均不能进行细胞固定。 |
|
Q5:处理后的样品与对照组相比较,红和绿两种荧光值都增加(或减少)了,结果该如何解释? |
| A5:请先比较实验组和对照组的荧光比值,两者相比,荧光比越低,线粒体膜电位越低。
用荧光之比进行结果分析的理由。 JC-1由于膜电位依存性地在细胞中积蓄,根据细胞的状态,每个细胞的JC-1的浓度有可能不同。 由于对照组和实验组处理样品的细胞状态不同,JC-1的累积浓度不同。) 另外,在线粒体膜电位较高的状态下,JC-1会聚集在一起,使荧光从绿色转移到红色。 该聚集体的量取决于膜电位的程度,因此可以用红/绿之比来比较样品之间的线粒体膜电位。 <参考文献> 1) Cossarizza, A. et al., Biochem Biophys Res Commun., 1993, 197(1), 40. 2) Perelman, A. et al., Cell Death and Disease, 2012, 3, e430 3) Smiley, S. T. et al., Proc. Nail. Acad. Sci., 1991, 88, 3671. |
关联产品





上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
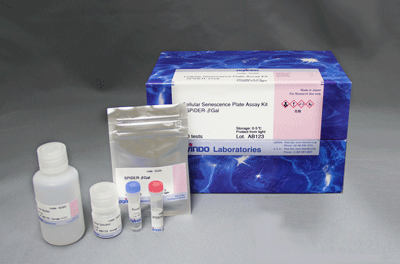
 Cellular Senescence Detection Kit – SPiDER-βGal
Cellular Senescence Detection Kit – SPiDER-βGal
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 10 assays | ¥44,200 | 347-09181 |
| 10 assays | [10 assays: 35 mm dish] ・SPiDER-βGal ・Bafilomycin A1 |
x 1 x 1 |
|---|
技術情報の目次
細胞周期のG2/M 期に作用して細胞増殖を停止させ、細胞老化を誘導することが知られているDoxorubicin(DOX) をA549 細胞へ添加後、本製品で細胞老化、Cell Cycle Assay Solution Blue (製品コード:C549)/ Deep Red(製品コード:C548)でA549 細胞における細胞周期の変化と、JC-1 MitoMP Detection Kit (製品コード:MT09)でミトコンドリア膜電位の変化を確認しました。
|

Cell Cycle Assay Solution Blue
JC-1 MitoMP Detection Kit
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) |
細胞(HEK) |
蛍光顕微鏡 フローサイトメーター |
T. Doura, M. Kamiya, F. Obata, Y. Yamaguchi, T. Y. Hiyama, T. Matsuda, A. Fukamizu, M. Noda, M. Miura, Y. Urano, "Detection of LacZ-Positive Cells in Living Tissue with Single-Cell Resolution.", Angew Chem Int Ed Engl., 2016, 55, 33 |
| 2) | 組織(マウス脂肪) | 蛍光顕微鏡 | T. Sugizaki, S. Zhu, G. Guo, A. Matsumoto, J. Zhao, M. Endo, H. Horiguchi, J. Morinaga, Z. Tian, T. Kadomatsu, K. Miyata, H. Itoh & Y. Oike, "Treatment of diabetic mice with the SGLT2 inhibitor TA-1887 antagonizes diabetic cachexia and decreases mortality", Nature Partner Journal:Aging and Mechanisms of Disease., 2017, doi:10.1038/s41514-017-0012-0. |
| 3) |
細胞 |
蛍光顕微鏡 | A. Park, I. Tsunoda and O. Yoshie, "Heat shock protein 27 promotes cell cycle progression by down-regulating E2F transcription factor 4 and retinoblastoma family protein p130", J. Biol. Chem., 2018, doi: 10.1074/jbc.RA118.003310 . |
| 4) | 細胞(A549) | 蛍光顕微鏡 フローサイトメーター |
R. Tanino, Y. Tsubata, N. Harashima, M. Harada and T. Isobe, "Novel drug-resistance mechanisms of pemetrexed-treated non-small cell lung cancer", Oncotarget., 2018, 9, (24), 16807. |
| 5) | 細胞(NHDF) | 蛍光顕微鏡 | Y. Kitahiro, A. Koike, A. Sonoki, M. Muto, K. Ozaki and M. Shibano. , "Anti-inflammatory activities of Ophiopogonis Radix on hydrogen peroxide-induced cellular senescence of normal human dermal fibroblasts.", J Nat Med., 2018, 72, 905. |
| 6) |
組織 |
蛍光顕微鏡 | R. Uchida, Y. Saito, K. Nogami, Y. Kajiyama, Y. Suzuki, Y. Kawase, T. Nakaoka, T. Muramatsu, M. Kimura and H. Saito, "Epigenetic silencing of Lgr5 induces senescence of intestinal epithelial organoids during the process of aging", NPJ Aging Mech Dis., 2018, doi:10.1038/s41514-018-0031-5. |
| 7) |
組織(腎臓凍結切片) |
蛍光顕微鏡 | S. R. Kim, A. Eirin, X. Zhang, A. Lerman and L. O. Lerman, "Mitochondrial Protection Partly Mitigates Kidney Cellular Senescence in Swine Atherosclerotic Renal Artery Stenosis.", Cell. Physiol. Biochem., 2019, 52, 617. |
| 8) |
細胞(HN6, HN12, HN13) |
フローサイトメーター | Liana P. Webber, Veronica Q. Yujra, Pablo A. Vargas, Manoela D. Martins. Cristiane H. Squarize, Rogerio M. Castilho, "Interference with the bromodomain epigenome readers drives p21 expression and tumor senescence", Cancer Letters., 2019, doi.org/10.1016/j.canlet.2019.06.019. |
| 9) |
細胞(UE7T-13) |
フローサイトメーター | H. Ise, K. Matsunaga, M. Shinohara and Y. Sakai, Improved Isolation of Mesenchymal Stem Cells Based on Interactions between N-Acetylglucosamine-Bearing Polymers and Cell-Surface Vimentin ", Stem Cells Int., 2019, 4341286, 13. |
| 10) |
細胞(マウス角膜間質) |
フローサイトメーター | X. Wang, M. Qu, J. Li, P. Danielson, L. Yang and Q. Zhou, Induction of Fibroblast Senescence During Mouse Corneal Wound Healing.", Invest. Ophthalmol. Vis. Sci., 2019, 60, (10), 3669. |
| 11) |
細胞(VZ/SVZ) |
フローサイトメーター | Y. Nakatani, H. Kiyonari and T. Kondo, Ecrg4 deficiency extends the replicative capacity of neural stem cells in a Foxg1-dependent manner.", Development., 2019, 146, (4), 18. |
| 12) |
細胞(HaCaT, HEK001) |
蛍光顕微鏡 | Y. S. Ryu, K. A. Kang, M. J. Piao, M. J. Ahn, J. M. Yi, G. Bossis, Y. M. Hyun, C. O. Park and J. W. Hyun, Particulate matter-induced senescence of skin keratinocytes involves oxidative stress-dependent epigenetic modifications", Exp. Mol. Med., 2019, 51, 108. |
| 13) |
細胞(HT1080) |
蛍光顕微鏡 | E. M. Angela Ibler, E. Mohamed, L. N. Kathryn, A. B. Natalia, F. E. K. Sherif and H. Daniel, Typhoid toxin exhausts the RPA response to DNA replication stress driving senescence and Salmonella infection', Nat Commun., 2019, 10, 4040. |
| 14) | – (Review) | フローサイトメーター | B.L. Torres, A. Estepa-Fernandez, M. Rovira, M. Oraez, M. Serrano, R. Martinez-Manez and F. Sancenon,"The chemistry of senescence.", The chemistry of senescence., 2019, (3), 426-411 |
| 15) |
細胞(HepG2) |
蛍光顕微鏡 | 三谷塁一, "肝臓のミトコンドリア活性化に及ぼす大豆イソフラボンの効果と その分子機構に関する研究", 大豆たん白質研究, 2019, 21 |
| 16) |
細胞(PC12) |
蛍光顕微鏡 | N. Wang, H. Wang, L. Li, Y. Li and R. Zhang, "β-Asarone Inhibits Amyloid-β by Promoting Autophagy in a Cell Model of Alzheimer's Disease.", Front Pharmacol., 2020, 10, 1529 |
| 17) |
細胞(A2780) |
フローサイトメーター | Z. Wang, J. Gao, Y. Ohno, H. Liu and C. Xu, "Rosiglitazone ameliorates senescence and promotes apoptosis in ovarian cancer induced by olaparib.", Cancer Chemother Pharmacol., 2020. |
| 18) |
組織 |
蛍光顕微鏡 フローサイトメーター |
J. H. Cho, E. Kim, Y. Son, D. Lee, Y. S. Park, J. H. Choi, K. Cho, K. Kwon and J. Kim, "CD9 Induces Cellular Senescence and Aggravates Atherosclerotic Plaque Formation.", Cell Death Differ., 2020, doi: 10.1038/s41418-020-0537-9 |
| 19) |
細胞(T cell) |
フローサイトメーター | S. Yoshida, H. Nakagami, H. Hayashi, Y. Ikeda, J. Sun, A. Tenma, H. Tomioka, T. Kaawano, M. Shimamura, R. Morishita and H. Rakugi, "The CD153 vaccine is a senotherapeutic option for preventing the accumulation of senescent T cells in mice.", Nat. Commun., 2020, 11, (2482), doi:10.1038/s41467-020-16347-w |
| 20) |
細胞(PC12) |
蛍光顕微鏡 | N. Wang, H. Wang, L. Li, Y. Li and R. Zhang, "β-Asarone Inhibits Amyloid-β by Promoting Autophagy in a Cell Model of Alzheimer's Disease.", Front Pharmacol., 2020, 10, 1529 |
| 21) |
細胞(ARPE-19) |
蛍光顕微鏡 | T. Yamazaki, H. Suzuki, S. Yamada, K. Ohshio, M. Sugamata, T. Yamada and Y. Morita, "Lactobacillus paracasei KW3110 Suppresses Inflammatory Stress-Induced Premature Cellular Senescence of Human Retinal Pigment Epithelium Cells and Reduces Ocular Disorders in Healthy Humans”, Int J Mol Sci, 2020, 21(14), 5091 |
| 22) | 細胞 (ゼブラフィッシュの上皮細胞) | 蛍光顕微鏡 | Y. Haraoka, Y. Akieda, Y. Nagai, C. Mogi and T. Ishitani, "Zebrafish imaging reveals TP53 mutation switching oncogene-induced senescence from suppressor to driver in primary tumorigenesis", Nat. Commun., 2022, doi:10.1038/s41467-022-29061-6. |
| 23) | 組織 (脂肪組織) | 蛍光顕微鏡 | A. Kita, Y. Saito, N. Miura, M. Miyajima, S. Yamamoto, T. Sato, T. Yotsuyanagi, M. Fujimiya and T. Chikenji, "Altered regulation of mesenchymal cell senescence in adipose tissue promotes pathological changes associated with diabetic wound healing", Commun. Biol., 2022, doi:10.1038/s42003-022-03266-3. |
| 24) | 細胞(hMPC) | 蛍光顕微鏡 | X. Liu, Z. Liu, Z. Wu, J. Ren, Y. Fan, L. Sun, G. Cao, Y. Niu, B. Zhang, Q. Ji, X Jiang, C. Wang, Q. Wang, Z. Ji, L. Li, C. R. Esteban, K. Yan, W. Li, Y. Cai, S. Wang, A. Zheng, Y. E. Zhang, S. Tan, Y. Cai, M. Song, F. Lu, F. Tang, W. Ji, Q. Zhou, J. Belmonte, W. Zhang, J. Qu, G. Liu, "Resurrection of endogenous retroviruses during aging reinforces senescence", Cell, 2023, doi:10.1016/j.cell.2022.12.017. |
1キット当りの使用回数の目安は?
目安となる使用回数については、下記の容器毎の数量をご参考ください。

※1ウェル当りに添加する染色溶液の量によって上記の数量は変わります。
使用する容器と必要な1ウェル当りの染色溶液量を予め確認の上、ご使用ください。
Bafilomycin A1 を添加する理由を教えて下さい。
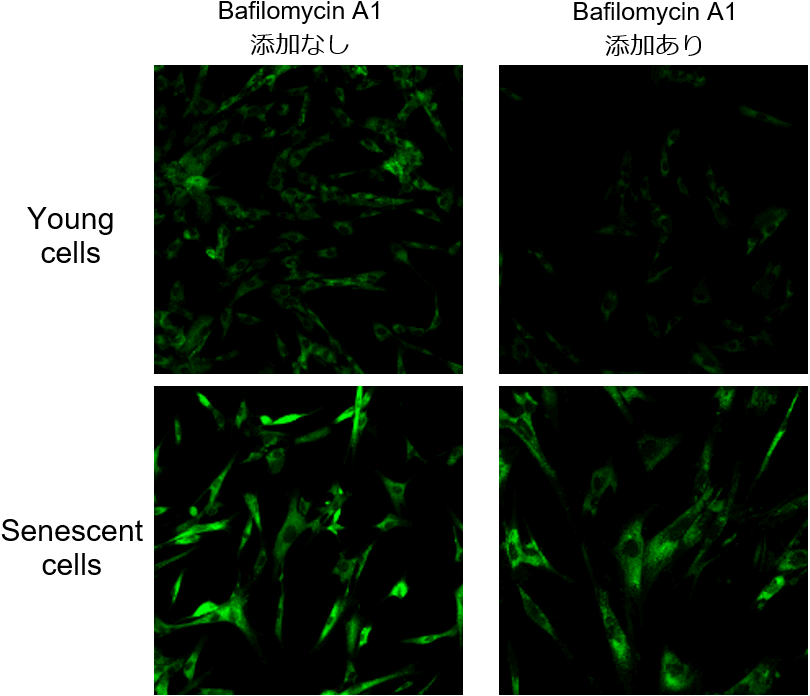
多くの細胞には内在性のβ-ガラクトシダーゼの存在が知られていますが、SPiDER-βGalは、内在性のβ-ガラクトシダーゼと老化マーカーであるSA-β-Galともに反応するため、老化が認められていない細胞でも、バックグラウンドが高くなり、SA-β-Galの検出に支障が出てきます。
Bafilomycin A1は、リソソーム中のATPase活性を阻害し、リソソーム中のpHを酸性から中性付近に変化させますが、この作用により内在性β-ガラクトシダーゼの活性が低下します。そのため、SPiDER-βGalを添加する前にBafilomycin A1で細胞を処理することで、SPiDER-βGalはSA-β-Galと反応して老化細胞を蛍光染色することができます。
左図ではBafilomycin A1の添加有無によるSA-β-Gal検出の違いを示しています。
なお、Bafilomycin A1は、オートファジー阻害剤としての利用も知られています。ご利用の際は、実験系に支障があるかご検討の上、支障が有る場合は、固定化細胞の利用をお勧めします。固定化細胞を用いる場合は、バッファーで細胞内pHをコントロールするため、Bafilomycin A1 は使用しません。取扱説明書に記載された手順に従って染色することができます。
DMSO stock solutionは、どのくらい安定ですか?
SPiDER-βGal DMSO stock solution及びBafilomycin A1 DMSO stock solution調製後は、-20℃保存した場合に1か月間安定であることを確認しています。
Working solutionは、どのくらい安定ですか?
SPiDER-βGal working solution及びBafilomycin A1 working solutionは保存できないため、用時調製して下さい。
老化細胞を蛍光観察する際の注意点はありますか?
細胞老化が進むと細胞内にリポフスチンと呼ばれる不溶性物質が蓄積してきます。リポフスチンは自家蛍光を発するため蛍光観察時にバックグラウンドとして影響することがあります。その場合、老化細胞中のSA-β-gal活性を正確に評価するために、SPiDER-βGalを添加しない試料もご用意いただき確認することをお勧めします。
○フローサイトメーターの場合
・「老化細胞」および「老化していない細胞」を用いて、各々①②の平均蛍光強度(MFI)を測定してください。
①SPiDER-βGalを添加した細胞
②SPiDER-βGalを添加していない細胞(バックグラウンド)
・「①の平均蛍光強度」から「②の平均蛍光強度」を差し引いてください。
バックグラウンドを差し引いたSA-β-gal由来の蛍光強度をSA-β-gal活性の指標とします。
a:SA-β-gal活性(老化細胞) = ①の平均蛍光強度 - ②の平均蛍光強度
b:SA-β-gal活性(老化していない細胞) = ①の平均蛍光強度 - ②の平均蛍光強度
・上記の aおよびb の値を比較することで、SA-β-gal活性として評価してください。
また、上記のaからbを差し引くことで細胞老化に伴うSA-β-gal活性の変化を確認できます。
○蛍光顕微鏡の場合
・初めにSPiDER-βGalを添加していない老化細胞を用いて蛍光観察してください。
・リポフスチン由来の蛍光像(バックグラウンド)が影響を与えない程度に感度(gainなど)を調整してください。
・その後、同じ撮影条件でSPiDER-βGalを添加した細胞や老化していない細胞の蛍光観察を行い評価してください。
細胞を固定化した後に、SA-β-galは染色できますか?
可能です。固定化した場合、Bafilomycin A1を用いた細胞の前処理は必要ありませんが、pH6.0に調整したMcIlvain bufferを別途準備して頂く必要があります。詳細は取扱説明書をご覧ください。
固定化細胞をフローサイトメーターを用いて検出するプロトコルを教えて下さい。
下記のプロトコルを参照ください。
(1) 細胞を35 mmディッシュに播種し、37℃、5% CO2インキュベーターで一晩培養する。
(2) 培地を吸引除去し、HBSS 2 mlで1回洗浄する。
(3) トリプシンで細胞を剥がし、培地500 μlで回収する。
(4) 300×gで5分間遠心し、上澄みを除去する。
(5) 2% PFA/PBS 100 μlに懸濁し、室温で5分間固定する。
(6) 300×gで5分間遠心し、上澄みを除去する。
(7) HBSS 500 μLに懸濁し、300×gで5分間遠心後、上澄みを除去する。これを2回繰り返す。
(8) SPiDER-βGal working solution(固定化細胞用) 500 μlを加え、37℃で30分間インキュベートする。
※pHの変動を抑えるため、5% CO2インキュベーターは使用しない。
(9) 300×gで5分間遠心し、上澄みを除去する。
(10) HBSS 500 μlに懸濁し、300×gで5分間遠心後、上澄みを除去する。これを2回繰り返す。
(11) HBSS 500 μlを加えて細胞を回収し、フローサイトメーターにて解析する。
細胞を固定化後にSA-β-gal検出および免疫染色はできますか?
はい、染色は可能ですが、細胞を固定化するとSA-β-galが低下する可能性があります。 (下記の※2に注意事項を記載)
以下の実験例を参照しご検討ください。
WI-38細胞を固定化後に、SA-β-gal検出およびγ-H2AX(DNA損傷マーカー)の免疫染色を行った。
<実験操作>
| (1) | WI-38細胞を35 mm dishに播種し、37℃、5% CO2インキュベーターで一晩培養した。 |
| (2) | 培養上清を除き、4% Paraformaldehyde/PBS溶液2 mlを細胞に添加し、室温で3分間インキュベートした※1。 |
| (3) | PBS 2 mlで細胞を3回洗浄した。 |
| (4) | SPiDER-βGal working solution ※2 2 mlを添加し、37℃で30分間インキュベートした※3。 |
| (5) | PBS 2 mlで細胞を2回洗浄した。 |
| (6) | 0.1% Triton X-100/PBS 2 mlを細胞へ添加し、室温で30分間インキュベートした。 |
| (7) | PBS 2 mlで2回洗浄した。 |
| (8) | 1% BSA/PBS溶液2 mlを細胞へ添加し、室温で1時間インキュベートした。 |
| (9) | 抗γ-H2AX IgG (マウス由来)を1% BSA/PBS溶液にて希釈後、細胞に添加し4℃で一晩インキュベートした。 |
| (10) | PBS 2 mlで細胞を3回洗浄した。 |
| (11) | 抗マウスIgG(Cy5標識)を1% BSA/PBSで希釈後、細胞に添加し室温で1時間インキュベートした。 |
| (12) | 上清を除き、PBS 2 mlで細胞を2回洗浄し蛍光顕微鏡下で観察した。 |
| ※1 | 固定化時間を長くすると、SA-β-gal活性が低下します。 |
| ※2 | 細胞の固定化操作によりSA-β-gal活性が低下する可能性があります。 もしSA-β-gal評価時に十分な蛍光強度が得られない場合は、SPiDER-βGal DMSO stock solution を500-1000倍に希釈しご使用ください。通常はSPiDER-βGal DMSO stock solutionをMcIlvaine buffer(pH 6.0)にて2,000倍の希釈を推奨。 希釈倍率の異なるSPiDER-βGal working solutionの結果をFig.1に示す。 |
| ※3 | インキュベートの際は、5% CO2インキュベーターでは行わないこと。5% CO2インキュベーター内に固定化した細胞をおくと、バッファーが酸性になることで内在性のβ-galactosidase活性が上昇することが考えられる。結果として、バックグラウンドが上昇し、老化細胞と若い細胞のSA-β-gal活性の差が見えにくくなる。 |
<実験データ>
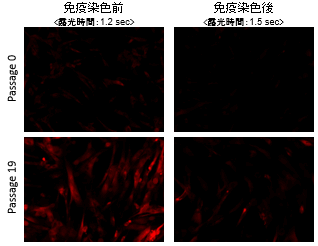 図1 免染前後におけるSPiDER-βGal染色の蛍光強度変化 |
免疫染色の前後でSPiDER-βGalの蛍光強度を比較すると、固定化を行う免疫染色の過程でSPiDER-βGalの蛍光強度が低下していることを確認した。
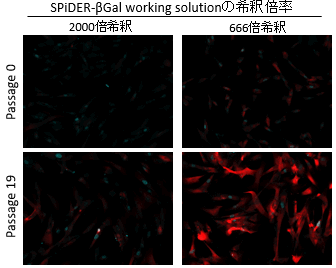 図2 希釈倍率の異なるSPiDER-βGalによる染色例(免疫染色後) 赤: SPiDER-βGal、青: γ-H2AX <露光時間: 1.5 sec> |
SPiDER-βGal working solutionの希釈倍率を2000倍から666倍に変更することで、免疫染色(固定化)により低下したSPiDER-βGalの蛍光強度が免疫染色前と同程度の強度を示すことを確認した。
染色後の蛍光が弱くて確認できないのですが、対策を教えてください。
下記の3点についてご確認またはご検討ください。
①ご使用のフィルターが試薬の蛍光特性に合致している。
<推奨フィルター>
・蛍光顕微鏡: 励起(500-540 nm), 蛍光(530-570 nm)
・フローサイトメーター: 励起(488 nm), 蛍光(500-540 nm)
②各working solutionは用時調製したものを使用する。
③染色時間を長くする。
SPiDER-βGal working solution添加後、30分間のインキュベーションで蛍光が確認できない場合は、インキュベーション時間を45-60分間を目安にご検討ください。
SA-β-Gal発現細胞を染色後、細胞は固定化できますか?
可能です。4%パラホルムアルデヒドを用いて固定化することを推奨します。
培地中の血清やフェノールレッドは検出に影響しますか?
培地中の血清およびフェノールレッドは、SA-β-galの検出には影響しません。
老化細胞とコントロール細胞で蛍光強度に差がない場合、何を確認したら良いですか?
STEP1:顕微鏡の観察条件を最適化してください。
STEP2:観察条件を最適化しても解決しない場合、染色条件の最適化を行ってください。
—————————————————————————
STEP1<顕微鏡の観察条件を最適化>
コントロール細胞の蛍光と老化細胞の蛍光に差が見られない場合下記をご確認ください。
・コントロール細胞を観察し蛍光が僅かに確認できる条件までGain、レーザー強度を下げる、または露光時間を短くする。
(共焦点顕微鏡:Gain、レーザー強度の調整 落射型顕微鏡:露光時間の調整)
・老化細胞の蛍光を観察し、コントロール細胞との蛍光の差を確認する。
・蛍光の差がみられない場合はSTEP2を確認する。
※観察する部分がガラスボトムシャーレの容器をお使いください。
顕微鏡観察条件とコントロールおよび老化細胞の蛍光強度の関係
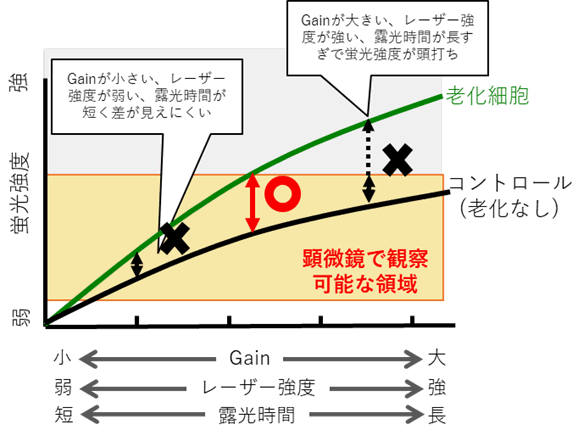
—————————————————————————
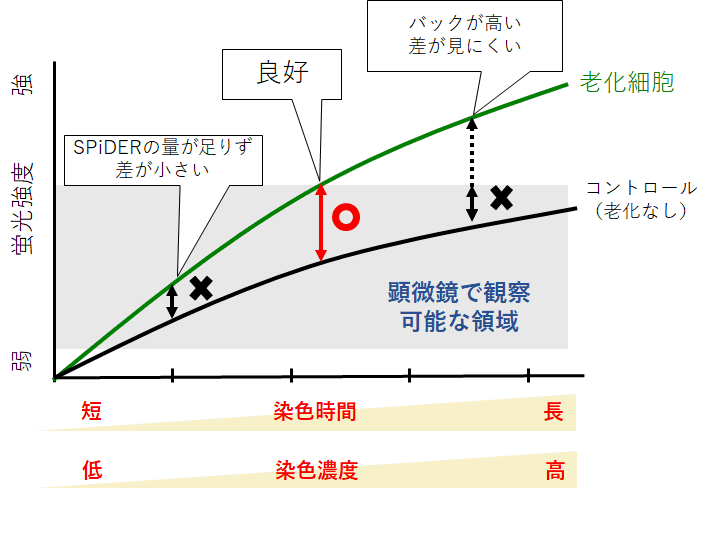
STEP2<染色条件の最適化>
細胞によっては、SPiDERの染色時間もしくは濃度の検討が必要な場合がございます。
以下を目安に最適条件をご検討ください。
染色時間:10分~60分
染色濃度:取扱説明書に記載の濃度の1/2量~2倍量
※観察する細胞数が少ないと感度が得られない場合がございます。
必要に応じて、細胞数の最適化を行ってください。
染色条件とコントロールおよび老化細胞の蛍光強度の関係


| 保存条件: 冷蔵 |

この製品に関連する研究では、下記の関連製品も使われています。
Cellular Senescence Plate Assay Kit – SPiDER-βGal

Nucleolus Bright Green
DNA Damage Detection Kit – γH2AX - Green
ROS Assay Kit -Highly Sensitive DCFH-DA-
Lysosomal Acidic pH Detection Kit
上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
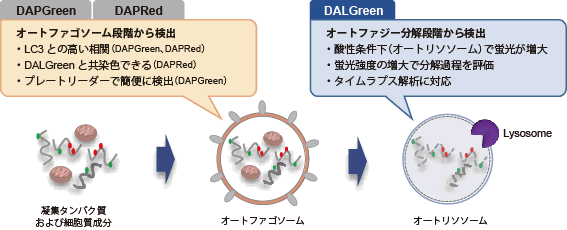
 DALGreen – Autophagy Detection
DALGreen – Autophagy Detection
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 20 nmol | ¥31,900 | 344-09191 |
 DALGreenの最適濃度の検討については、
DALGreenの最適濃度の検討については、
よくある質問の「DALGreenの最適濃度の検討方法を教えてください」
をご覧ください。




 |
|
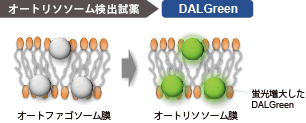 |
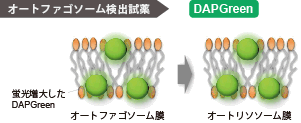
DAPGreen、DAPRedと同様にオートファゴソーム形成時に色素が膜に取り込まれます。その後、リソソームと融合し酸性環境になったときにDALGreenの蛍光が増大します。 |
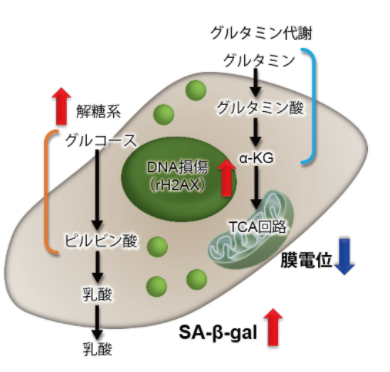
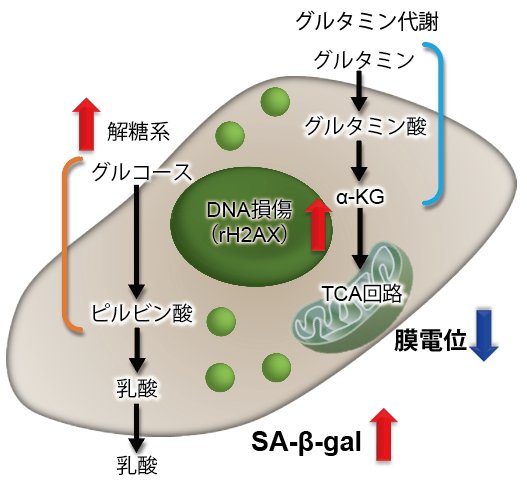
グルタミン代謝とオートファジー
グルタミナーゼの安定化を介してオートファジーとグルタミノリシスを促進するタンパク質に関する報告例を紹介!
その他、疾患と細胞内代謝指標との関連性をマップでわかりやすく紹介しています。

| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) | 細胞 (HeLa, MEF) |
蛍光顕微鏡 | H. Iwashita, H. T. Sakurai, N. Nagahora, M. Ishiyama, K. Shioji, K. Sasamoto, K. Okuma, S. Shimizu, and Y. Ueno, "Small fluorescent molecules for monitoring autophagic flux.", FEBS Letters., 2018, 592, (4), 559–567. |
| 2) | 細胞 (HeLa) |
蛍光顕微鏡 | T. Sakata, A. Saito and H. Sugimoto, "In situ measurement of autophagy under nutrient starvation based on interfacial pH sensing.", Scientific Reports., 2018, 8, 8282. |
| 3) | 細胞 (HS-MM) |
蛍光顕微鏡 | Y. Egawa, C. Saigo, Y. Kito, T. Moriki and T. Takeuchi, "Therapeutic potential of CPI-613 for targeting tumorous mitochondrial energy metabolism and inhibiting autophagy in clear cell sarcoma.", PLoS One., 2018, 13, (6), e0198940. |
| 4) | 細胞 (HaCaT) |
蛍光顕微鏡 | S. Abe, S. Hirose, M. Nishitani, I. Yoshida, M. Tsukayama, A. Tsuji and K. Yuasa, "Citrus peel polymethoxyflavones, sudachitin and nobiletin, induce distinct cellular responses in human keratinocyte HaCaT cells.", Biosci. Biotechnol. Biochem. ., 2018, 82, (12), 1347. |
| 5) | 細胞 (KGN) |
蛍光顕微鏡 | W. Yuping, M. Congshun, Z. Huihui, Z. Yuxia, C. Zhenguo and W. Liping, "Alleviation of endoplasmic reticulum stress protects against cisplatin-induced ovarian damage.", Reprod. Biol. Endocrinol., 2018,doi: 10.1186/s12958-018-0404-4. |
| 6) | 細胞 (BmN) |
蛍光顕微鏡 | S. Xue, F. Mao, D. Hu, H. Yan, J. Lei, E. Obeng, Y. Zhou, Y. Quan, and W. Yu, "Acetylation of BmAtg8 inhibits starvation-induced autophagy initiation.", Mol. Cell Biochem., 2019,doi: 10.1007/s11010-019-03513-y. |
| 7) | 細胞 (HeLa) |
蛍光顕微鏡 | F. Hongbao, Y. Shankun, C. Qixin, L. Chunyan, C. Yuqi, G. Shanshan, B. Yang, T. Zhiqi, L. Z. Amanda, T. Takanori, C.Yuncong, G. Zijian, H. Weijiang and D. Jiajie, "De Novo-Designed Near-Infrared Nanoaggregates for Super-Resolution Monitoring of Lysosomes in Cells, in Whole Organoids, and in Vivo.", ACS Nano, 2019, 13, (12), 1446. |
| 8) | 細胞 (RT-7) |
フローサイトメーター | E. Sasabe, A. Tomomura, N. Kitamura and T. Yamamoto, "Metal nanoparticles-induced activation of NLRP3 inflammasome in human oral keratinocytes is a possible mechanism of oral lichenoid lesions.", Toxicol In Vitro., 2020, 62, 104663. |
| 9) | 細胞 (骨髄腫) |
蛍光顕微鏡 | J. Xia, Y. He, B. Meng, S. Chen, J. Zhang, X. Wu, Y. Zhu, Y. Shen, X. Feng, Y. Guan, C. Kuang, J. Guo, Q. Lei, Y. Wu, G. An, G. Li, L. Qiu, F. Zhan and W. Zhou, "NEK2 induces autophagy-mediated bortezomib resistance by stabilizing Beclin-1 in multiple myeloma.", Mol Oncol, 2020, DOI: 10.1002/1878-0261.12641. |
| 10) | 細胞 (Human L2) |
蛍光顕微鏡 | Q. Xu, W. Shi, P. Lv, W. Meng, G. Mao, C. Gong, Y. Chen, Y. Wei, X. He, J. Zhao, H. Han, M. Sun and K. Xiao, "Critical role of caveolin-1 in aflatoxin B1-induced hepatotoxicity via the regulation of oxidation and autophagy.", Cell Death Dis., 2020, 11(1), 6. |
| 11) | 細胞 (心筋) |
蛍光顕微鏡 | L Cui, LP Zhao, JY Ye, L Yang, Y Huang, X.P. Jiang, Q. Zhang, JZ. Jia, DX. Zhang and Y. Huang, "The Lysosomal Membrane Protein Lamp2 Alleviates Lysosomal Cell Death by Promoting Autophagic Flux in Ischemic Cardiomyocytes.", Front Cell Dev Biol, 2020,DOI:10.3389/fcell.2020.00031. |
| 12) | 細胞 (IPEC-J2) |
蛍光顕微鏡 | Y Yang, J Huang, J Li, H Yang and Y. Yin, "The Effects of Butyric Acid on the Differentiation, Proliferation, Apoptosis, and Autophagy of IPEC-J2 Cells..", Curr. Mol. Med., 2020, 20(4), 307. |
| 13) | 細胞 (線維芽細胞、腎臓上皮細胞) | 蛍光顕微鏡 | M. M. Ivanova, J. Dao, N. Kasaci, B. Adewale, J. Fikry and O. G. Alpan, "Rapid Clathrin-Mediated Uptake of Recombinant α-Gal-A to Lysosome Activates Autophagy", Biomolecules, 2020, 10(6), 837. |
| 14) |
細胞 (NHEKs) |
蛍光顕微鏡 | S. Ikeoka and A. Kiso, "The Involvement of Mitophagy in the Prevention of UV-B-Induced Damage in Human Epidermal Keratinocytes ", J. Soc. Cosmet. Chem. Jpn., 2020, 54(3), 252. |
| 15) | 細胞 (HeLa) |
蛍光顕微鏡(超解像) | Q. Chen, M. Hao, L. Wang, L. Li, Y. Chen, X. Shao, Z. Tian, R. A. Pfuetzner, Q. Zhong, A. T. Brunger, J. Guan and J. Diao, "Prefused lysosomes cluster on autophagosomes regulated by VAMP8", Cell Death Dis., 2021, doi:10.1038/s41419-021-04243-0. |
| 16) | 細胞 (SH-SY5Y) |
蛍光顕微鏡 | Chang-ki Oh, Nima Dolatabadi, Piotr Cieplak, Maria T. Diaz-Meco, Jorge Moscat, John P. Nolan, Tomohiro Nakamura and Stuart A. Lipton, "S-Nitrosylation of p62 Inhibits Autophagic Flux to Promote α-Synuclein Secretion and Spread in Parkinson’s Disease and Lewy Body Dementia", J. Neurosci., 2022, doi:10.1523/JNEUROSCI.1508-21.2022. |
DALGreen working solutionは、どのくらい安定ですか?
保存できません。用時調製してください。
DMSO stock solutionは、どのくらい安定ですか?
調製後は、-20℃で保存してください。調製後1ヶ月間安定です。
また使用量に応じて小分けし保存することをお勧めします。
オートファジーに関連するタンパク質をノックダウンし評価した実績はありますか?
オートファゴソーム膜形成に関与しているULK1及びULK2をノックダウンした細胞と野生株の細胞を飢餓誘導し、DALGreenにて評価した実績がございます。
評価では、ULK1/ULK2ノックダウン細胞に比べ、野生株ではDALGreenの蛍光が増大している結果が得られています。
本評価データは下記論文のSupporting Information(Fig. S5)をご参照ください。
なお、オートファジーのマーカーであるLC3-RFPとDALGreenを共染色し、殆どのPuncta(斑点)が共局在する結果も得られております。本実験データは、下記論文のFig..1をご参照ください。
H. Iwashita, H. T. Sakurai, N. Nagahora, M. Ishiyama, K. Shioji, K. Sasamoto, K. Okuma, S. Shimizu, and Y. Ueno, "Small fluorescent molecules for monitoring autophagic flux", FEBS Letters., 2018, 592, (4), 559–567.
論文へのリンクは製品HPにございます。
製品HP:DALGreen – Autophagy Detection
リソソーム染色試薬との違いはありますか?
リソソーム染色試薬は、細胞内のリソソームに局在します。一方、DALGreenはオートファゴソームに
局在した後、オートファゴソームとリソソームが融合した際に蛍光が増大します。
そのため、リソソーム染色試薬とDLGreenで共染色した場合、リソソーム染色試薬由来の蛍光のうち、オート
リソソームの部分がDALGreenの蛍光と重なります。
本評価データは下記論文のSupporting Information(Fig. S5)をご参照ください。
H. Iwashita, H. T. Sakurai, N. Nagahora, M. Ishiyama, K. Shioji, K. Sasamoto, K. Okuma, S. Shimizu, and Y. Ueno, "Small fluorescent molecules for monitoring autophagic flux", FEBS Letters., 2018, 592, (4), 559–567.
論文へのリンクは製品HPにございます。
製品HP:DALGreen – Autophagy Detection
推奨フィルターを教えてください。
励起フィルター:350~450 nm
蛍光フィルター:500~560 nm
なお、共焦点顕微鏡を用いて488 nm励起により蛍光観察した実績がございます。
弊社HP内の製品ページの実験例を参照ください。
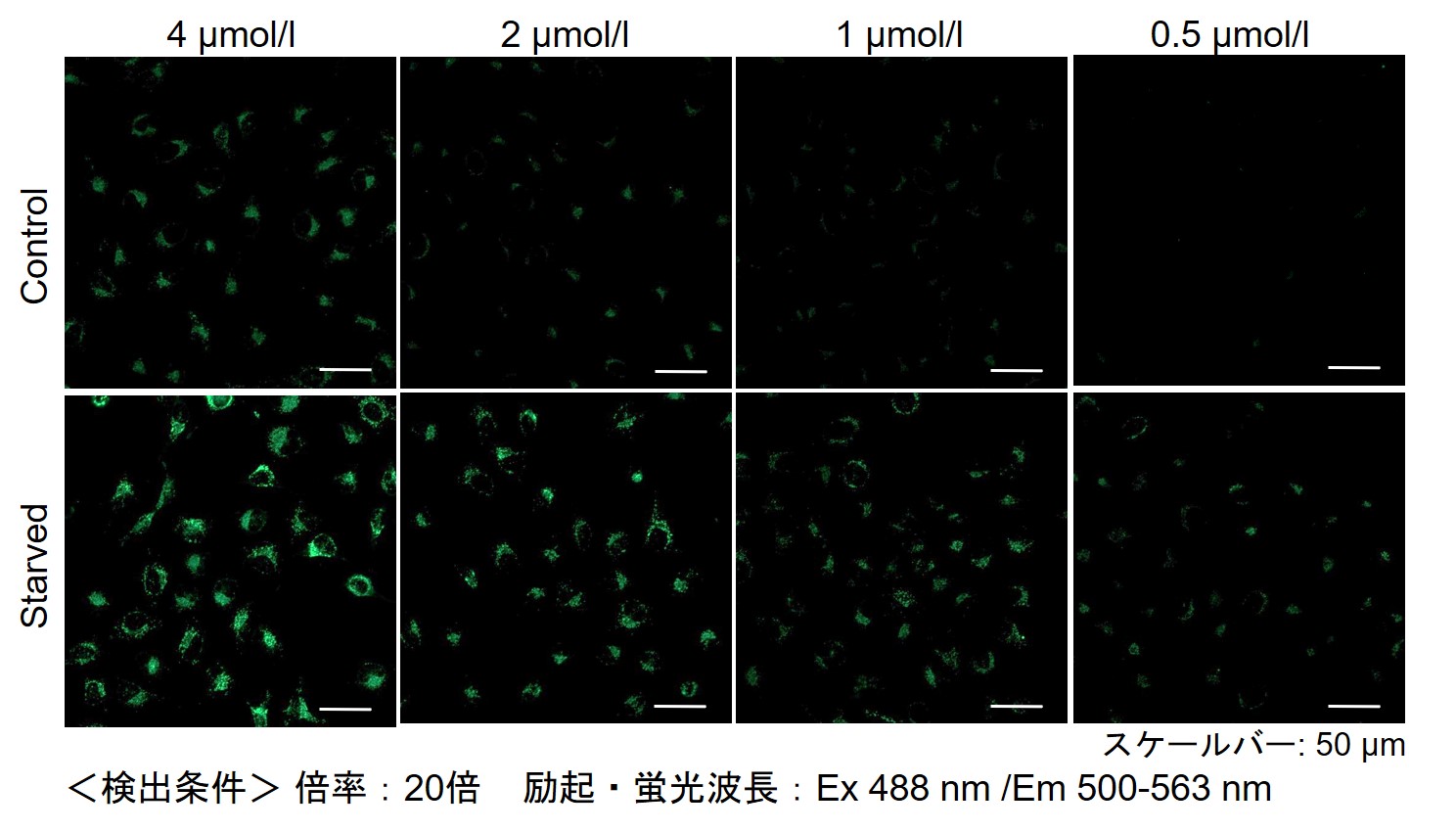
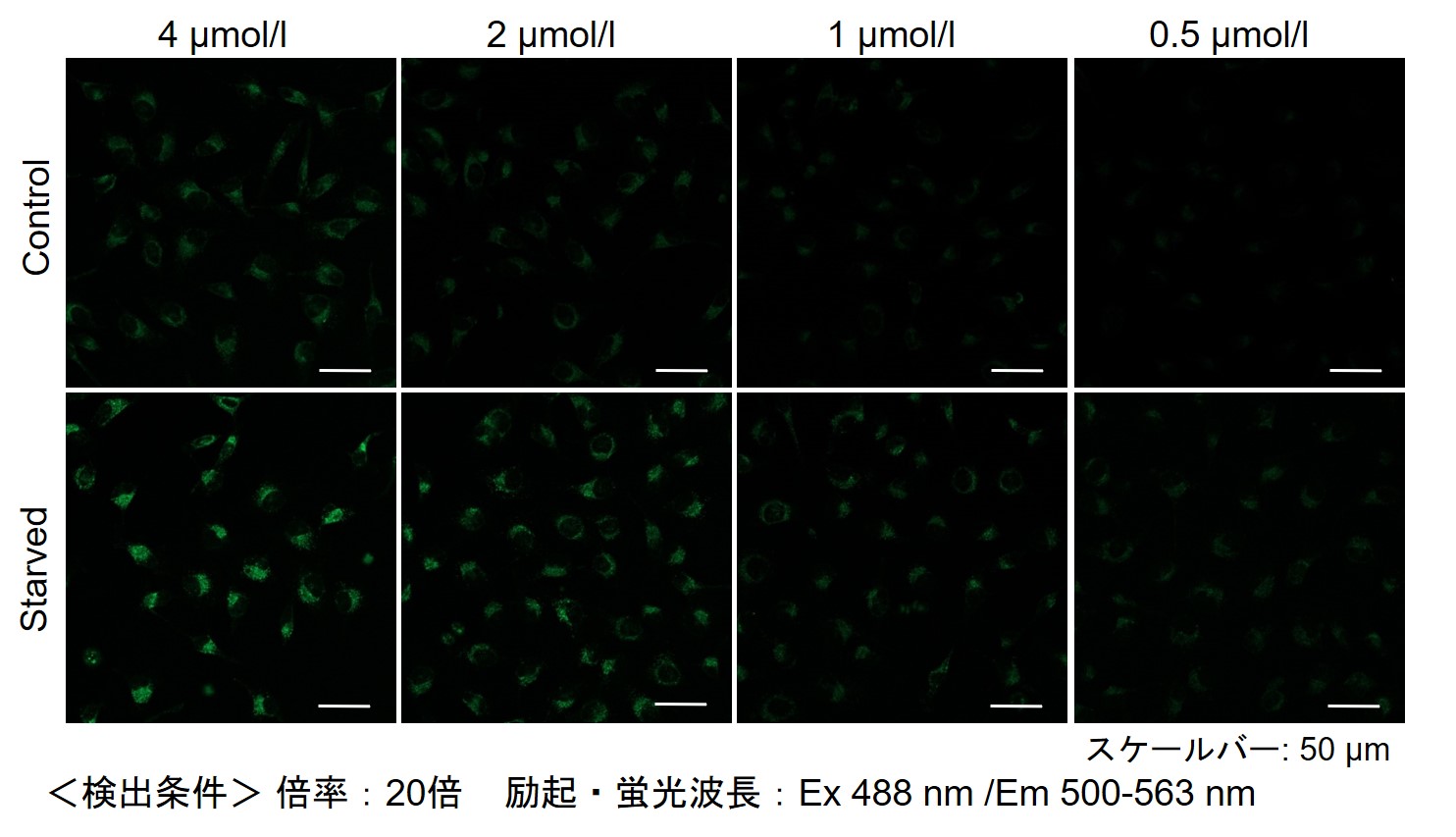
DALGreenの最適濃度の検討方法を教えてください。
試薬の特性により、試薬の濃度が高すぎたり低すぎたりすると、オートファジー誘導時と誘導していないコントロールとの差が判りにくい場合があります。
下記の情報を参考に試薬濃度の検討することをお勧めします。
細胞種によりDALGreenの最適濃度は異なります。
DALGreenを薄い濃度から(目安0.1 μmol/l)から数点段階的に振ってご検討ください。
(濃い濃度は4 μmol/L前後を目安としてください)
(参考)
小社では、HeLa, HepG2、CHO細胞にて、細胞種毎のDALGreenの最適濃度の検討を行いました。
DALGreenを下記濃度で染色し、アミノ酸不含培地にて培養してオートファジーを誘導しました。
その結果、下記の赤字の濃度条件ではコントロールとの誘導時との差が見られました。
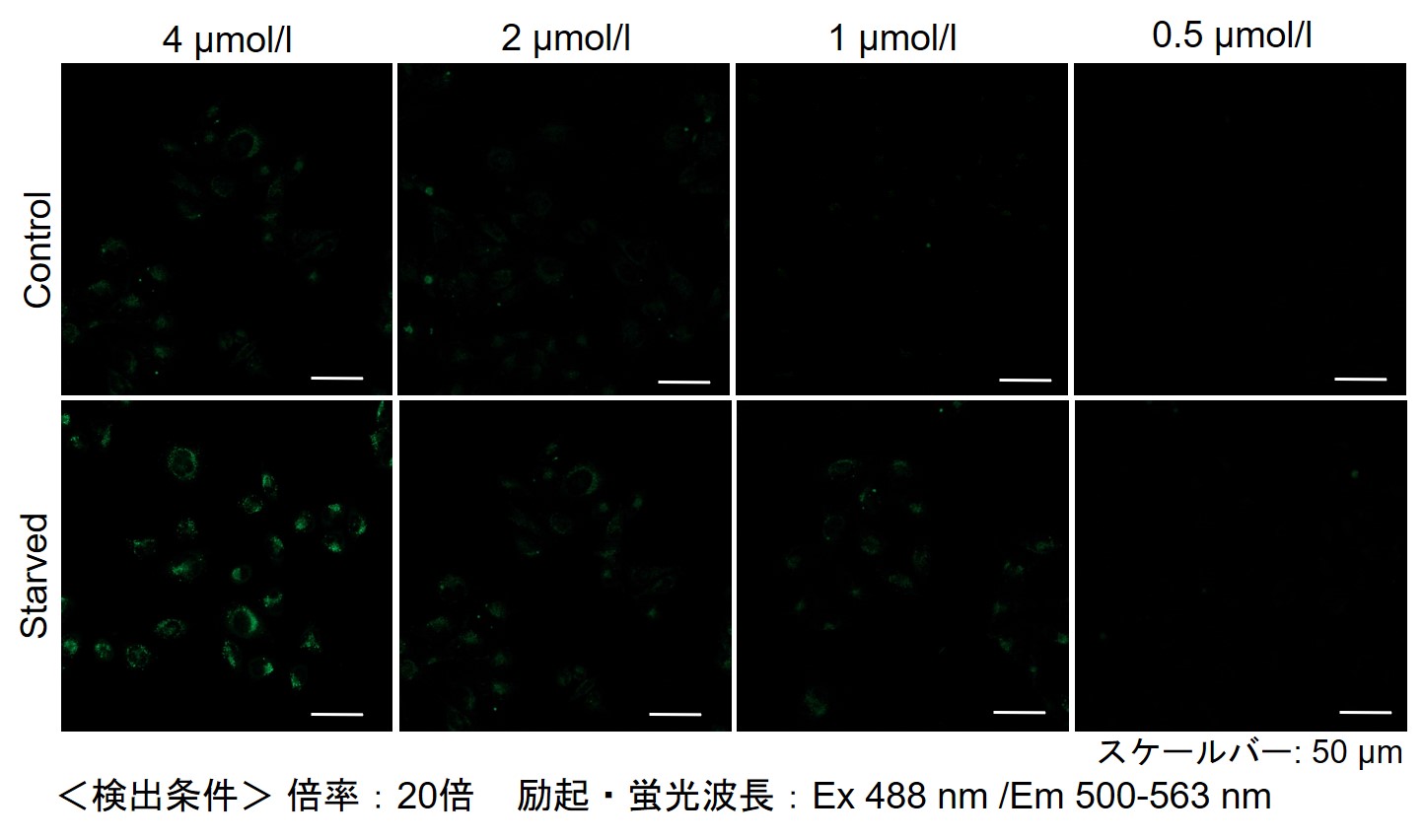
| 細胞種 | DALGreen 濃度 | |||
|---|---|---|---|---|
| HeLa | 4 µmol/l | 2 µmol/l | 1 µmol/l | 0.5 µmol/l |
| HepG2 | 4 µmol/l | 2 µmol/l | 1 µmol/l | 0.5 µmol/l |
| CHO | 4 µmol/l | 2 µmol/l | 1 µmol/l | 0.5 µmol/l |
【HeLa細胞】
【HepG2細胞】
【CHO細胞】
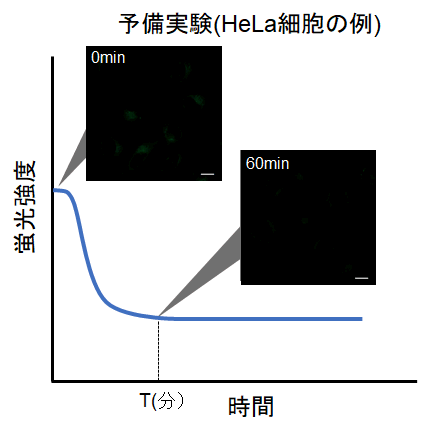
タイムラプスイメージングを行う上で注意点はありますか?
測定条件設定のための予備実験を行ってください。
試薬の特性上、染色直後は初期蛍光値が高くなる傾向があるため、以下の手順を参考に予備実験およびタイムラプスイメージングを行ってください。
①予備実験
・コントロール細胞(オートファジーを誘導しない細胞)を用いる。
・取扱説明書に従い、Working soluitonで染色後、培養培地で2回洗浄する。
・通常培地を添加した後、蛍光の時間変化を観察する。
・下図の様に、染色後に細胞内の蛍光が次第に低下した後、蛍光の変化が安定してくる時間(図中 T)を確認する。
※条件は細胞の種類により変わる可能性があります。
(参考)
HeLa細胞の場合、染色後の約60分経過すると蛍光強度が安定することを確認しております(DALGreen)。
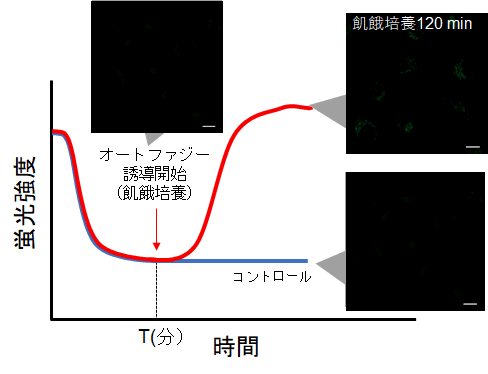
②タイムラプスイメージング
・細胞を Working solutionで染色後、培養培地中で細胞を37℃でインキュベートする。
※予備実験で設定した時間でインキュベートする。
※染色後、直ぐにはオートファジー誘導は行わない。
・インキュベート後にオートファジーの誘導を開始して、タイムラプスイメージングをする。
(参考)
HeLa細胞をDALGreenで染色し、通常培地中で60分間(予備実験で設定した時間)培養後、オートファジーを誘導しました。
オートファジーにはどのような経路があり、DALGreenはどの状態を検出するのですか?
オートファジーには、Atg5依存的オートファジー(LC3が変化する)とLC3の変化を伴わない、Atg5非依存的オートファジーがあることが知られております*。
DALGreenはオートファゴソーム膜に取り込まれ、その後、リソソームと融合し酸性環境下で蛍光が増大します。
そのため、DALGreenはオートリソソームの状態を検出します。
*参考資料 : 新たなオートファジー機構の発見 清水重臣
▶初めて検出する細胞種や実験系の場合は、よくある問い合わせ【 DALGreenの最適濃度の検討手順】をご参照ください。


| 性状: | 本品は淡黄色固体でメタノール及びジメチルスルホキシドに溶ける。 |
|---|---|
| 純度(HPLC): | 90.0% 以上 |
| 保存条件: 冷凍,遮光 , 取扱条件: 窒素置換 |

この製品に関連する研究では、下記の関連製品も使われています。

DAPRed – Autophagy Detection

Mitophagy Detection Kit
Cellular Senescence Detection Kit – SPiDER-βGal

Cell Counting Kit-8
上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 DAPGreen – Autophagy Detection
DAPGreen – Autophagy Detection
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 5 nmol | ¥40,900 | 340-09291 |
 DAPGreenの最適濃度の検討については、
DAPGreenの最適濃度の検討については、
よくある質問の「DAPGreenの最適濃度の検討方法を教えてください」
をご覧ください。



技術情報の目次
 |
|
 |
オートファゴソーム膜が形成される際に、DAPGreenは膜内に取り込まれ、脂溶性環境下に応答し蛍光が増大します。なお、オートファジーマーカーのLC3 を指標とした検出法とも高い相関性が得られています。 |
グルタミン代謝とオートファジー
グルタミナーゼの安定化を介してオートファジーとグルタミノリシスを促進するタンパク質に関する報告例を紹介!
その他、疾患と細胞内代謝指標との関連性をマップでわかりやすく紹介しています。

| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) | 細胞 (HeLa, MEF) |
蛍光顕微鏡 |
H. Iwashita, H. T. Sakurai, N. Nagahora, M. Ishiyama, K. Shioji, K. Sasamoto, K. Okuma, S. Shimizu, and Y. Ueno, "Small fluorescent molecules for monitoring autophagic flux.", FEBS Letters., 2018, 592, (4), 559–567. |
| 2) | 細胞 (HepG2; Huh-7) |
蛍光顕微鏡; フローサイトメーター |
L. Hu, T. Zhang, D. Liu, G. Guan, J. Huang, P. Proksch, X. Chen and W. Lin, "Notoamide-type alkaloid induced apoptosis and autophagy via a P38/JNK signaling pathway in hepatocellular carcinoma cells", RSC Adv., 2019, 9, 19855. |
| 3) | 細胞 (HepG2) |
蛍光顕微鏡 |
Q. Chu, S. Zhang, M. Chen, W. Han, R. Jia, W. Chen and X. Zheng, "Cherry Anthocyanins Regulate NAFLD by Promoting Autophagy Pathway", Oxid Med Cell Longev., 2019,DOI:10.1155/2019/4825949. |
| 4) | 細胞 (HLMVEC) |
蛍光顕微鏡 |
K. Koike, E. V. Berdyshev, A. M. Mikosz, I. A. Bronova, A. S. Bronoff, J. P. Jung, E. L. Beatman, K. Ni, D. Cao, A. K. Scruggs, K. A. Serban and I. Petrache, "Role of Glucosylceramide in Lung Endothelial Cell Fate and Emphysema", Am. J. Respir. Crit. Care Med., 2019,DOI:10.1164/rccm.201812-2311OC. |
| 5) | 細胞 (HeLa) |
蛍光顕微鏡 |
F. Hongbao,Y. Shankun, C. Qixin, L. Chunyan, C. Yuqi, G. Shanshan, B. Yang, T. Zhiqi, L. Z. Amanda, T. Takanori, C.Yuncong, G. Zijian, H. Weijiang and D. Jiajie , "De Novo-Designed Near-Infrared Nanoaggregates for Super-Resolution Monitoring of Lysosomes in Cells, in Whole Organoids, and in Vivo.", ACS Nano, 2019, 13, (12), 1446. |
| 6) | 細胞 (HeLa; A375) |
フローサイトメーター |
B. Yang, L. Ding, Y. Chen and J. Shi, "Augmenting Tumor-Starvation Therapy by Cancer Cell Autophagy Inhibition", Adv. Sci., 2020,DOI:10.1002/advs.201902847. |
| 7) | 細胞 (PC12) |
蛍光顕微鏡(超解像) |
Y. Tan, L. Yin, Z. Sun, S. Shao, W. Chen, X. Man,Y. Du and Y. Chen, "Astragalus polysaccharide exerts anti-Parkinson via activating the PI3K/AKT/mTOR pathway to increase cellular autophagy level in vitro.", Int. J. Biol. Macromol., 2020, DOI:10.1016/j.ijbiomac.2020.02.282. |
| 8) | 細胞 (Wild type Hepa 1-6) |
蛍光顕微鏡 (ImageJで数値化) |
Z. Peng, Y. Liao, X. Wang, L. Chen, L. Wang, C. Qin, Z. Wang, M. Cai, J. Hu, D. Li,P. Yao, A. K. Nüssler, L. Liu and W. Yang, "Heme oxygenase-1 regulates autophagy through carbon-oxygen to alleviate deoxynivalenol-induced hepatic damage., Arch. Toxicol., 2020, 94(2), 573. |
| 9) | 細胞 (マウス皮膚線維芽細胞) |
フローサイトメーター |
J. Kim, W.Y.Chee, N. Yabuta, K. Kajiwara, S. Nada and M. Okada, "Atg5-mediated autophagy controls apoptosis/anoikis via p53/Rb pathway in naked mole-rat fibroblasts", Biochem. Biophys. Res. Commun., 2020, 22, DOI:10.1016/j.bbrc.2020.05.083. |
| 10) | 細胞 (HeLa) |
蛍光顕微鏡(超解像) |
Q. Chen, M. Hao, L. Wang, L. Li, Y. Chen, X. Shao, Z. Tian, R. A. Pfuetzner, Q. Zhong, A. T. Brunger, J. Guan and J. Diao, "Prefused lysosomes cluster on autophagosomes regulated by VAMP8", 2021, doi:10.1038/s41419-021-04243-0. |
DAPGreen working solutionは、どのくらい安定ですか?
DAPGreen working solutionの保存はできません。用時調製してください。
DAPGreenのDMSO stock solutionは、どのくらい安定ですか?
DAPGreenのDMSO stock solutionは、調製後、-20℃、遮光下で保存してください。調製後1ヶ月間安定です。
また、使用量に応じて小分けし保存することをお勧めします。
推奨の励起・蛍光フィルターを教えてください。
励起フィルター:425~475 nm
蛍光フィルター:500~560 nm
なお、共焦点顕微鏡を用いて488 nm励起により蛍光観察した実績がございます。
弊社HP内の製品ページの実験例を参照ください。
タイムラプスイメージングを行う上で注意点はありますか?
測定条件設定のための予備実験を行ってください。
試薬の特性上、染色直後は初期蛍光値が高くなる傾向があるため、以下の手順を参考に予備実験およびタイムラプスイメージングを行ってください。
①予備実験
・コントロール細胞(オートファジーを誘導しない細胞)を用いる。
・取扱説明書に従い、Working soluitonで染色後、培養培地で2回洗浄する。
・通常培地を添加した後、蛍光の時間変化を観察する。
・下図の様に、染色後に細胞内の蛍光が次第に低下した後、蛍光の変化が安定してくる時間(図中 T)を確認する。
※条件は細胞の種類により変わる可能性があります。
(参考)
HeLa細胞の場合、染色後の約60分経過すると蛍光強度が安定することを確認しております(DAPGreen)。
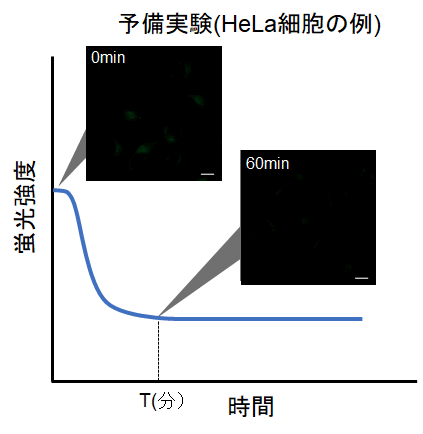
②タイムラプスイメージング
・細胞を Working solutionで染色後、培養培地中で細胞を37℃でインキュベートする。
※予備実験で設定した時間でインキュベートする。
※染色後、直ぐにはオートファジー誘導は行わない。
・インキュベート後にオートファジーの誘導を開始して、タイムラプスイメージングをする。
(参考)
HeLa細胞をDAPGreenで染色し、通常培地中で60分間(予備実験で設定した時間)培養後、オートファジーを誘導しました。
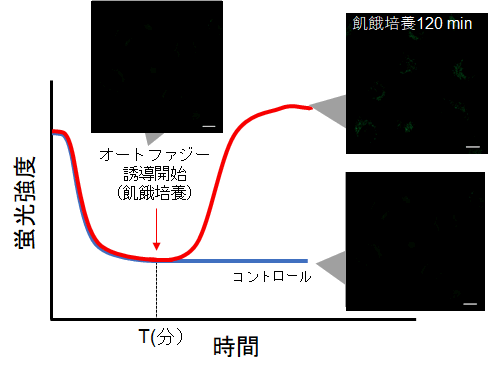
DAPGreenの最適濃度の検討方法を教えてください。
試薬の特性により、試薬の濃度が高すぎたり低すぎたりすると、オートファジー誘導時と
誘導していないコントロールとの差が判りにくい場合があります。
下記の情報を参考に試薬濃度の検討することをお勧めします。
細胞種によりDAPGreenの最適濃度は異なります。
DAPGreenを薄い濃度から(目安0.05 μmol/l)から数点段階的に振って
ご検討ください(濃い濃度は1 μmol/l前後を目安としてください)。
(参考)
小社では、HeLa, HepG2、CHO細胞にて、細胞種毎のDAPGreenの最適濃度の検討を行いました。
DAPGreenを下記濃度で染色し、アミノ酸不含培地にて培養し、オートファジーを誘導しました。
その結果、下記の赤字の濃度条件ではコントロールとの差が見られました。
| 細胞種 | 検討濃度 | |||
|---|---|---|---|---|
| HeLa | 0.4 µmol/l, | 0.2 µmol/l, | 0.1 µmol/l, | 0.05 µmol/l |
| HepG2 | 0.4 µmol/l, | 0.2 µmol/l, | 0.1 µmol/l, | 0.05 µmol/l |
| CHO | 0.4 µmol/l, | 0.2 µmol/l, | 0.1 µmol/l, | 0.05 µmol/l |
【HeLa細胞】
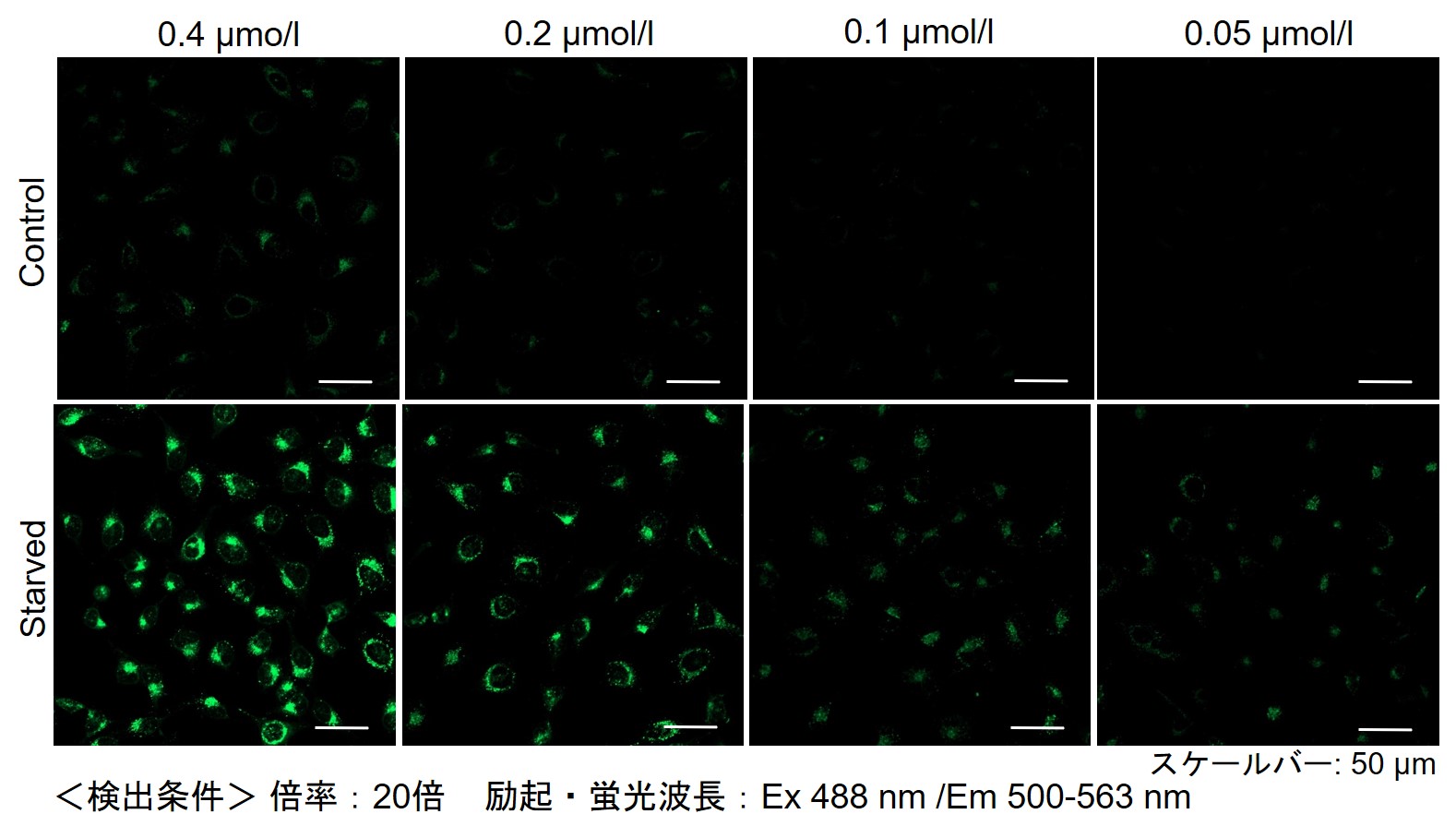
【HepG2細胞】
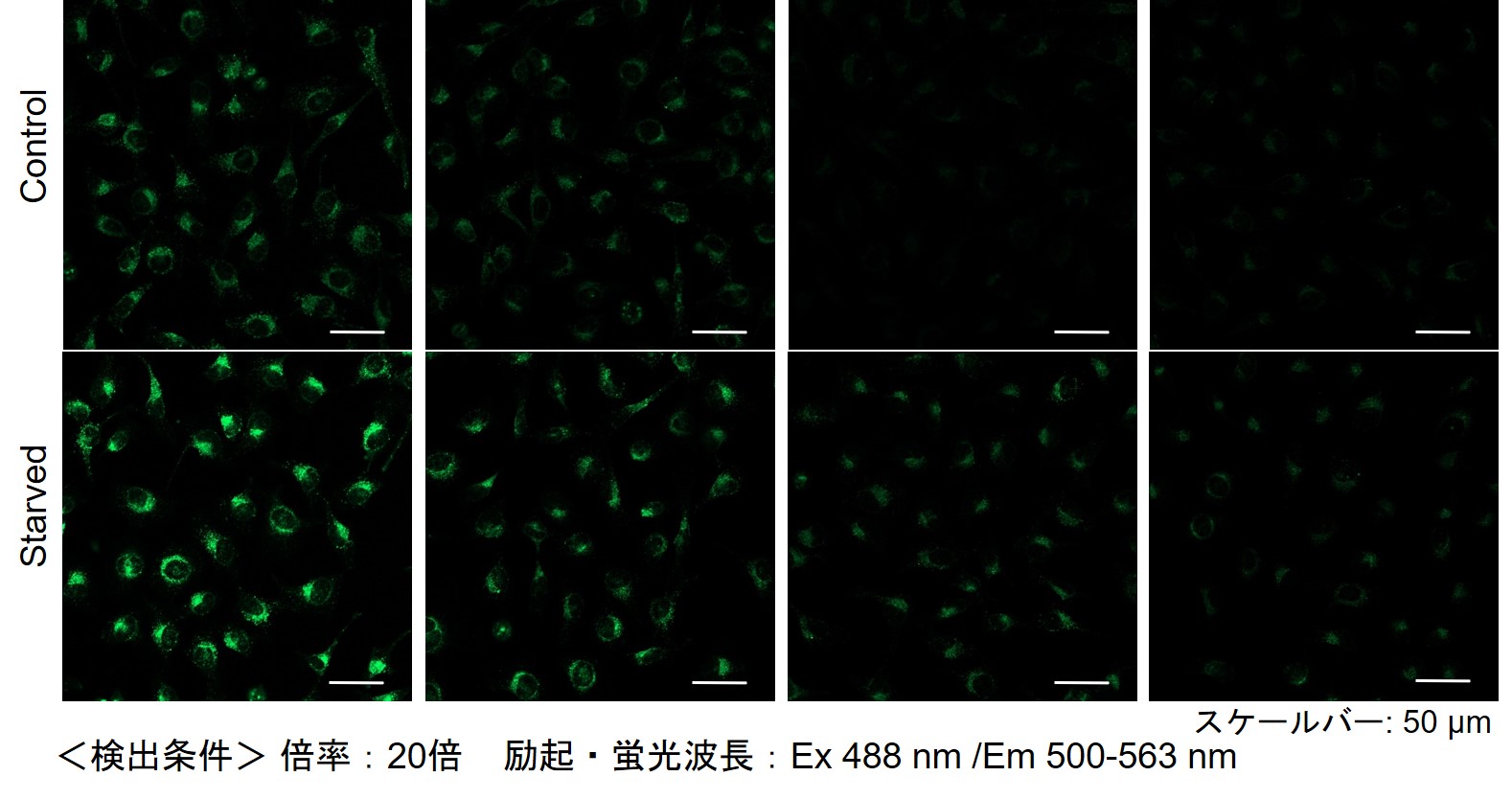
【CHO細胞】
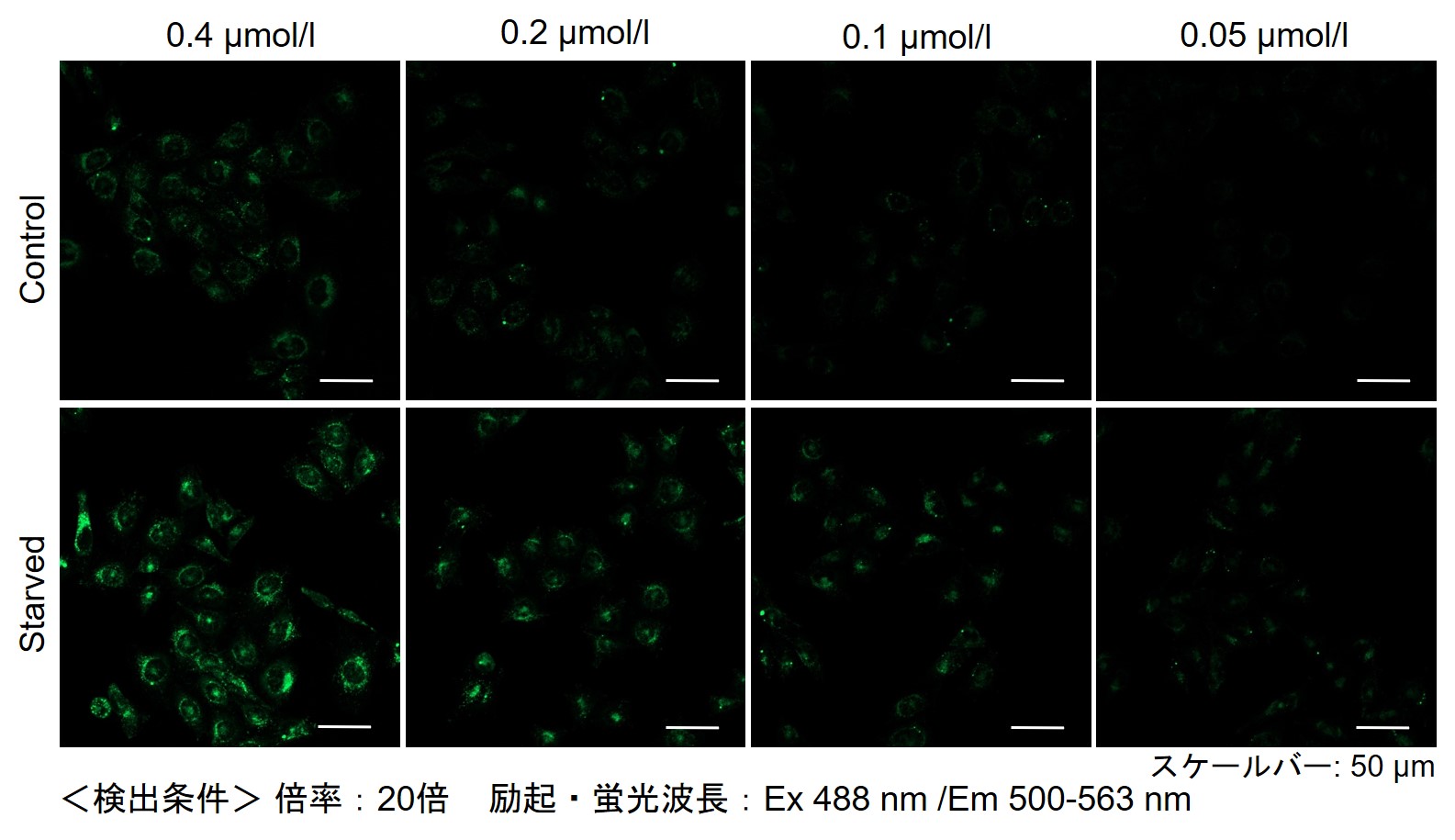
プレートリーダーでの定量解析の測定条件を教えてください。
HeLa細胞を用いた測定例は下記となります。
DAPGreenで染色後のHeLa細胞を、アミノ酸不含培地にて0、2、4、6時間培養し、プレートリーダーにて検出
<操作>
1) 透明底のブラックプレートに細胞を播種 (HeLa cell, 1.6×10^4 cells/well, 100 µl/well)
2) 一晩培養(37℃, 5%CO2)
3) 上清を除き培地で調整したWorking solution(DAPGreen:0.1 µmo/l)を100 µl添加
4) 37℃で30分間インキュベート(37℃, 5%CO2)
5) 培地で洗浄(100 µl×2回)
6) 飢餓培地(富士フィルム和光純薬, code:048-33575)を添加(100 µl)
7) 37℃で各時間インキュベート
8) プレートリーダー(TECAN,infinite pro M200)で測定(Ex/Em=450/530nm)
(0minはHBSSに置換して測定)
<結果>
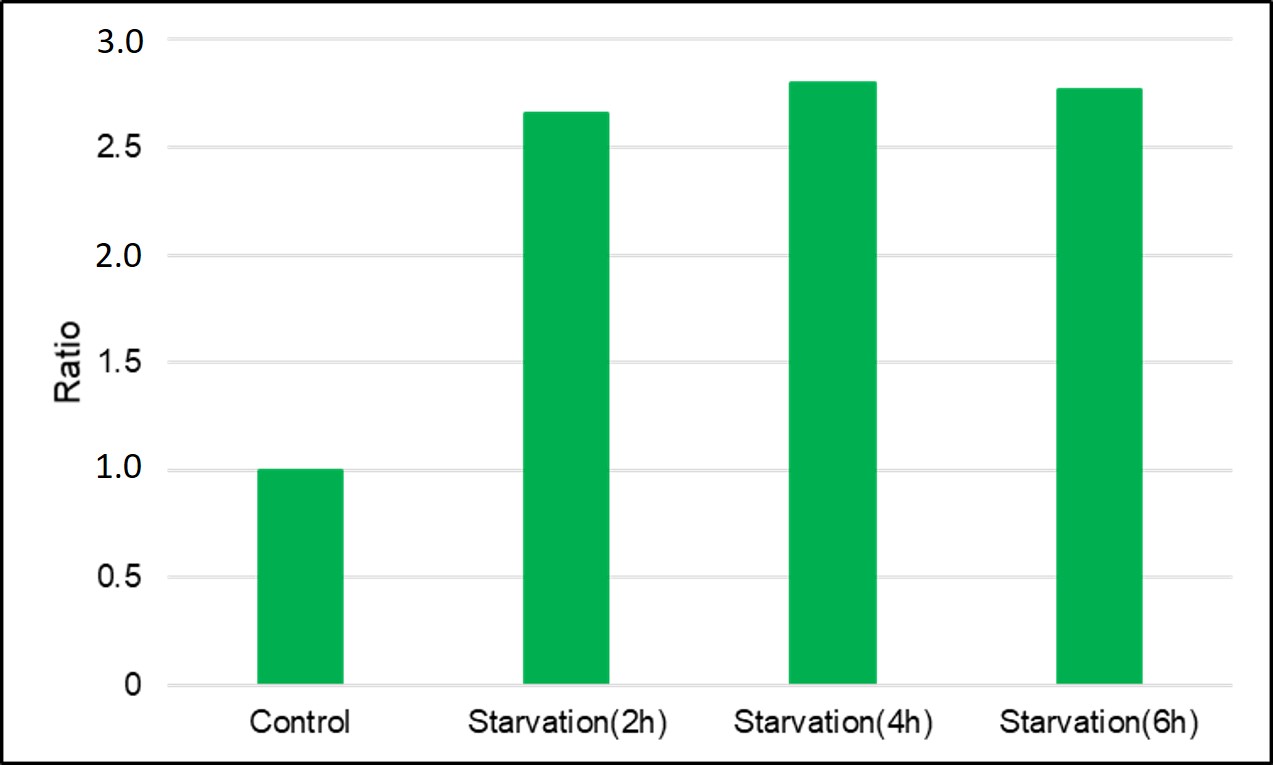 <検出条件> 波長 :Ex. 450 nm / Em. 535 nm
<検出条件> 波長 :Ex. 450 nm / Em. 535 nm
飢餓培養を開始してから2時間後には、コントロールより約3.5倍強い蛍光を確認した。
オートファジーにはどのような経路があり、 DAPGreenはどの状態を検出するのですか?
オートファジーには、Atg5依存的オートファジー(LC3が変化する)とLC3の変化を伴わない、Atg5非依存的オートファジーがあることが知られております*。
DAPGreenはオートファゴソーム膜に取り込まれ疎水環境下で蛍光を発し、オートファゴソームの状態を検出します。
*参考資料 : 新たなオートファジー機構の発見 清水重臣
▶初めて検出する細胞種や実験系の場合は、よくある問い合わせ【 DAPGreenの最適濃度の検討手順】をご参照ください。


| 性状: | 本品はメタノール及びジメチルスルホキシドに溶ける。 |
|---|---|
| 純度(HPLC): | 90.0% 以上 |
| 保存条件: 冷凍,遮光 , 取扱条件: 窒素置換 |

この製品に関連する研究では、下記の関連製品も使われています。

DALGreen – Autophagy Detection

Mitophagy Detection Kit
Cellular Senescence Detection Kit – SPiDER-βGal
Cytotoxicity LDH Assay Kit-WST
上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 DAPRed – Autophagy Detection
DAPRed – Autophagy Detection
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 5 nmol | ¥39,800 | 340-09551 |
 DAPRedの最適濃度の検討については、
DAPRedの最適濃度の検討については、
よくある質問の「DAPRedの最適濃度の検討方法を教えてください」
をご覧ください。



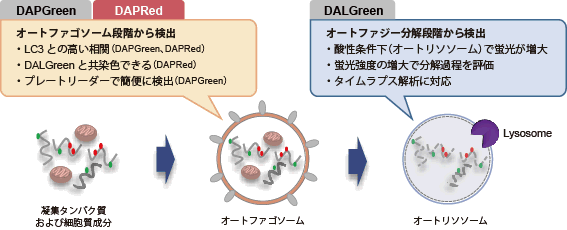
オートファゴソーム膜が形成される際に、DAPRedは膜内に取り込まれ、脂溶性環境下に応答し蛍光が増大します。なお、オートファジーマーカーのLC3 を指標とした検出法とも高い相関性が得られています。
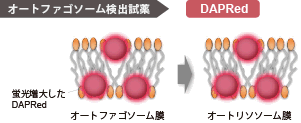
グルタミン代謝とオートファジー
グルタミナーゼの安定化を介してオートファジーとグルタミノリシスを促進するタンパク質に関する報告例を紹介!
その他、疾患と細胞内代謝指標との関連性をマップでわかりやすく紹介しています。

| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) | 細胞 (HUVEC) |
蛍光顕微鏡 | X. Chen, X. Yan, J. Liu and L. Zhang, " Chaiqi decoction ameliorates vascular endothelial injury in metabolic syndrome by upregulating autophagy.", Am. J. Transl. Res., 2020,12(9), 4902. |
| 2) | 細胞 (HeLa) |
蛍光顕微鏡 | H. Fang , S. Geng, M. Hao, Q. Chen, M. Liu, C. Liu, Z. Tian, C. Wang, T. Takebe, J-L Guan, Y. Chen, Z. Guo, W. He and J. Diao, "Simultaneous Zn2+ tracking in multiple organelles using super-resolution morphology-correlated organelle identification in living cells ", Nat Commun, 2021, 12(1), 109. 10.1016/j.envpol.2019.07.105. |
| 3) | 細胞 (HCT116; HCT8) |
蛍光顕微鏡 | H. Sun, R. Wang, Y. Liu, H. Mei and X. Liu , "USP11 induce resistance to 5-Fluorouracil in Colorectal Cancer through activating autophagy by stabilizing VCP", J Cancer , 2021, 12(8), 2317. |
| 4) | 細胞 (MEF) |
蛍光顕微鏡 | M. Yagi, T. Toshima, R. Amamoto, Y. Do, H. Hirai, D. Setoyama, D. Kang and T. Uchiumi, "Mitochondrial translation deficiency impairs NAD+-mediated lysosomal acidification", EMBO J, 2021, doi:10.15252/embj.2020105268. |
| 5) | 細胞 (SH-SY5Y) |
蛍光顕微鏡 | Chang-ki Oh, Nima Dolatabadi, Piotr Cieplak, Maria T. Diaz-Meco, Jorge Moscat, John P. Nolan, Tomohiro Nakamura and Stuart A. Lipton, "S-Nitrosylation of p62 Inhibits Autophagic Flux to Promote α-Synuclein Secretion and Spread in Parkinson’s Disease and Lewy Body Dementia", J. Neurosci., 2022, doi:10.1523/JNEUROSCI.1508-21.2022. |
DMSO stock solutionは、どのくらい安定ですか?
調製後は、-20℃、遮光下で保存してください。調製後1ヶ月間安定です。
また、使用量に応じて小分けし保存することをお勧めします。
Working solutionは、どのくらい安定ですか?
Working solutionの保存はできません。用時調製してください。
推奨の励起・蛍光フィルターを教えてください。
推奨フィルターは下記の通りです。
励起フィルター:500~560 nm
蛍光フィルター:690~750 nm
DAPRedの最適濃度の検討方法を教えてください。
試薬の特性により、試薬の濃度が高すぎたり低すぎたりすると、オートファジー誘導時と誘導していないコントロールとの差が判りにくい場合があります。
下記の情報を参考に試薬濃度の検討することをお勧めします。
細胞種毎でDAPRedの最適濃度が異なります。
DAPRedを薄い濃度から(目安0.05 μmol/l)から数点段階的に振ってご検討ください(濃い濃度は0.4 μmol/lを目安としてください)。
(参考)
小社では、HeLa, HepG2、CHO細胞にて、DAPRedの最適濃度の検討を行いました。
DAPRedを下記濃度で染色し、アミノ酸不含培地にて培養し、オートファジーを誘導しました。
その結果、下記の赤字の濃度条件ではコントロールとの差が見られました。
| 細胞種 | 検討濃度 | |||
|---|---|---|---|---|
| HeLa | 0.4 µmol/l | 0.2 µmol/l | 0.1 µmol/l | 0.05 µmol/l |
| HepG2 | 0.4 µmol/l | 0.2 µmol/l | 0.1 µmol/l | 0.05 µmol/l |
| CHO | 0.4 µmol/l | 0.2 µmol/l | 0.1 µmol/l | 0.05 µmol/l |
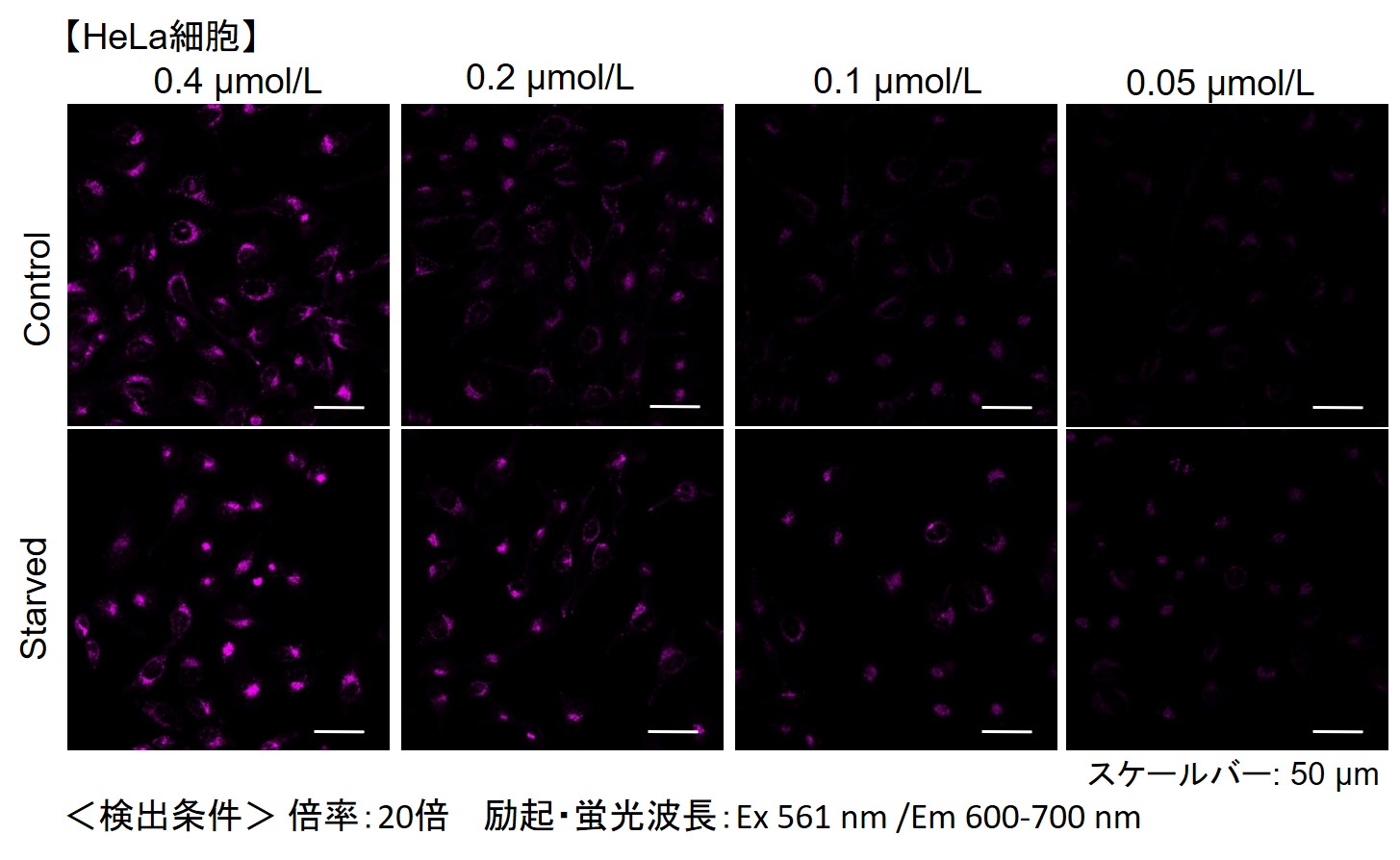
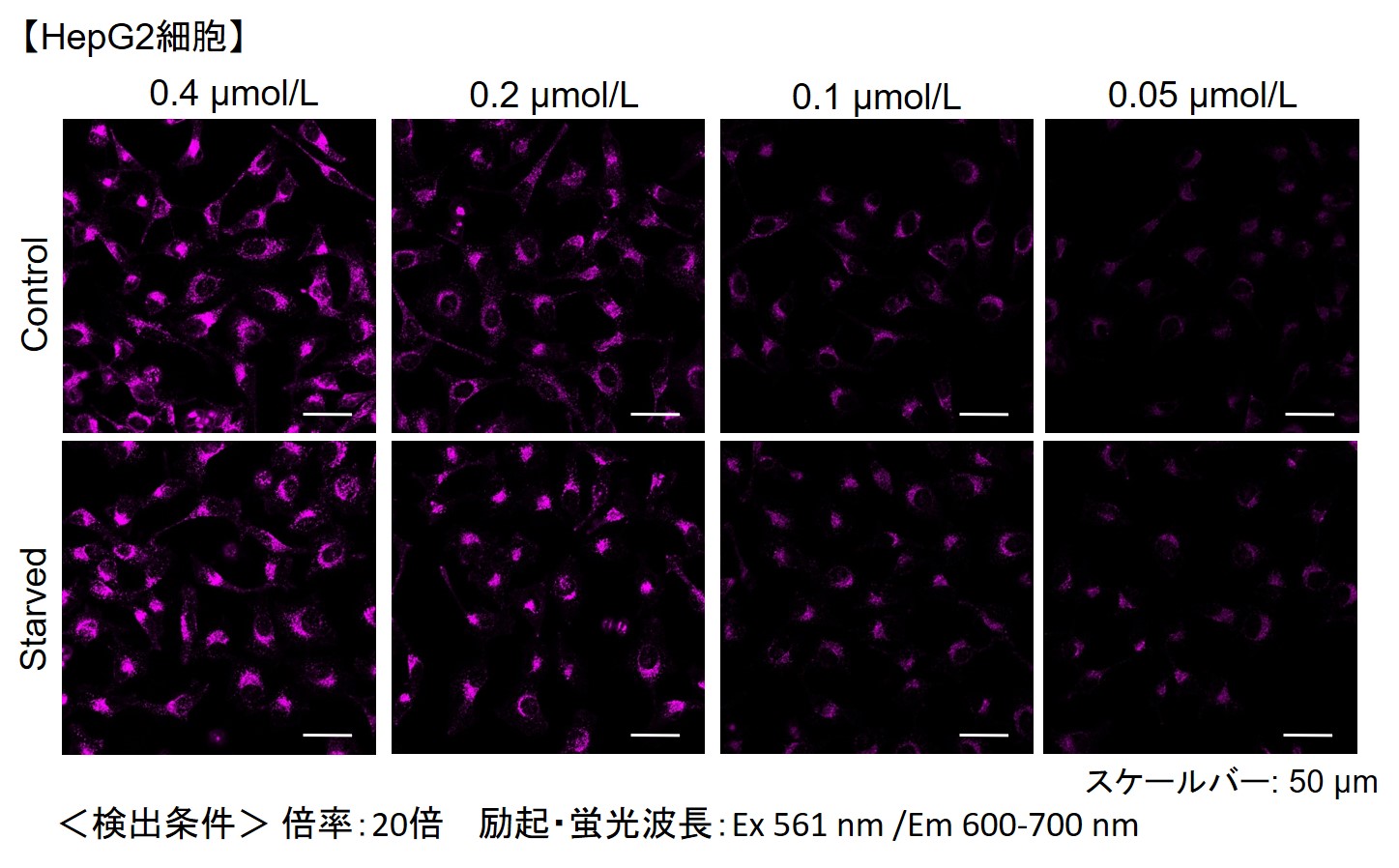
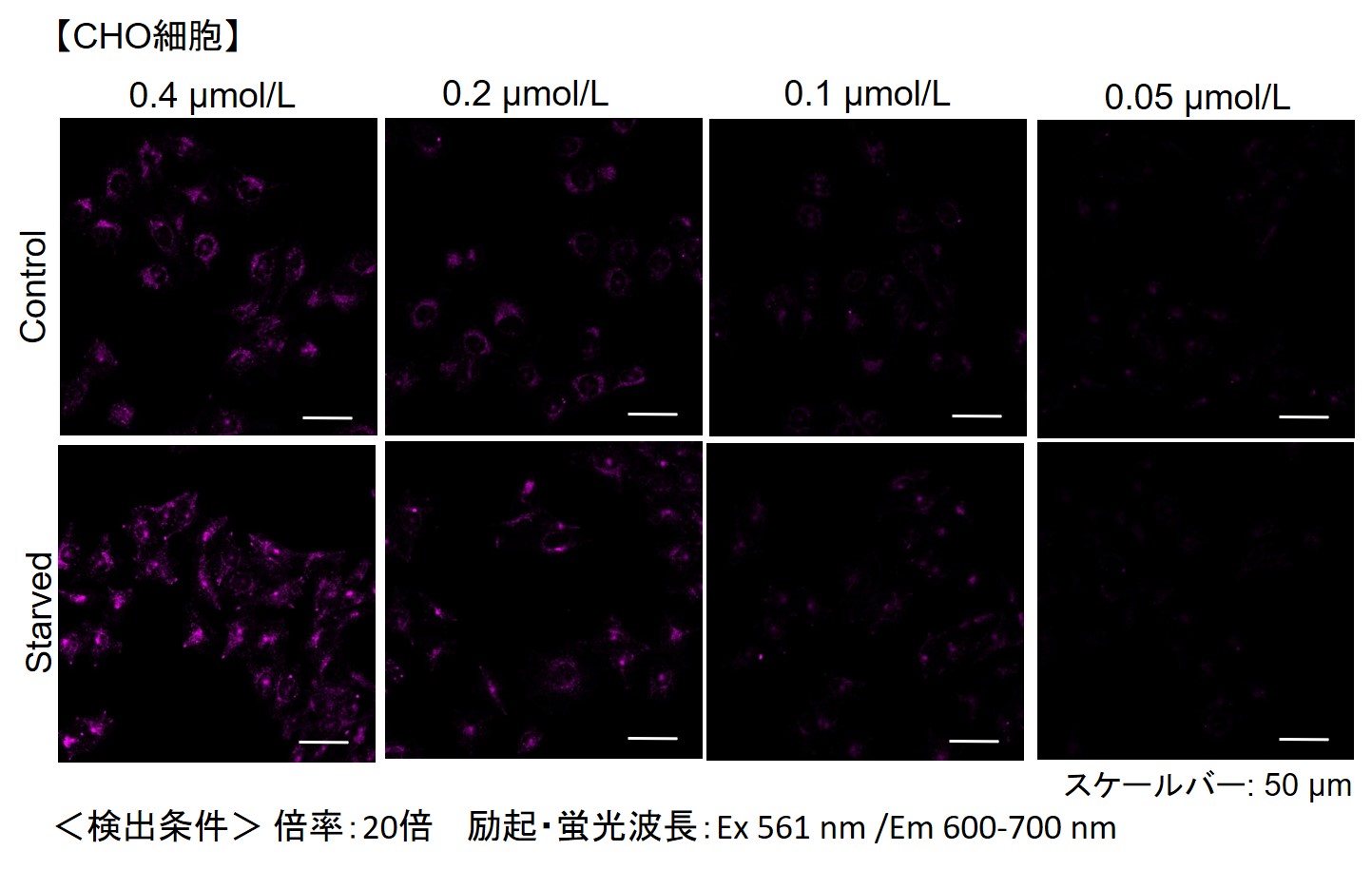
オートファジーにはどのような経路があり、 DAPRedはどの状態を検出するのですか?
オートファジーには、Atg5依存的オートファジー(LC3が変化する)とLC3の変化を伴わない、Atg5非依存的オートファジーがあることが知られております*。
DAPRedはオートファゴソーム膜に取り込まれ疎水環境下で蛍光を発し、オートファゴソームの状態を検出します。
*参考資料 : 新たなオートファジー機構の発見 清水重臣
▶初めて検出する細胞種や実験系の場合は、よくある問い合わせ【 DAPRedの最適濃度の検討手順】をご参照ください。


| 性状: | 本品は赤褐色固体でメタノール及びジメチルスルホキシドに溶ける。 |
|---|---|
| 純度(HPLC): | 93.0% 以上 |
| 保存条件: 冷蔵,遮光 |

この製品に関連する研究では、下記の関連製品も使われています。

Lipid Droplet Assay Kit – Blue
上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 DNA Damage Detection Kit – γH2AX - Green
DNA Damage Detection Kit – γH2AX - Green
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 set | ¥37,700 | 343-09421 |
| 1 set | ・Anti γH2AX antibody ・Secondary antibody – Green ・Blocking Solution |
×1 ×1 22 ml×1 |
|---|


DNA ダメージにより二重鎖切断が生じると、ヒストンタンパク質の一種であるH2AX が速やか、かつ広範囲にわたってリン酸化されます。リン酸化H2AX(γH2AX) は、DNA ダメージの鋭敏なマーカーであることから、化学物質や活性酸素、紫外線や放射線などの遺伝毒性及び発がん性評価への応用が期待されています。また、γH2AX の検出は近年では細胞老化を評価する指標としても知られています。
本製品はモノクローナル抗体研究所製の抗γH2AX 抗体を使用しています。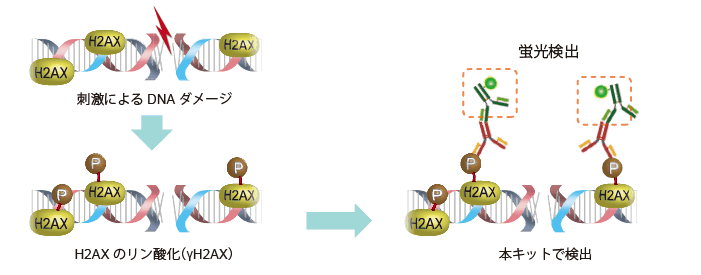
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1 | 細胞 (B16 Cell) |
フローサイトメーター | J. Takahashi, S. Nagasawa, M. J. Ikemoto, C. Sato, M. Sto and H. Iwahashi, "Verification of 5-Aminolevurinic Radiodynamic Therapy Using a Murine Melanoma Brain Metastasis Model", Int. J. Mol. Sci. ., 2019, 20, (5155), . |
| 2 | 細胞 (ヒト小気道上皮細胞) |
蛍光顕微鏡 | M. Komura, T. Sata, H. Yoshikawa, N. A. Nitta, Y. Suzuki, K KOike, Y. Kodama, K. Seyama and K. Takahashi, "Propylene glycol, a component of electronic cigarette liquid, damages epithelial cells in human small airways", 2022, Respir. Res., doi:10.1186/s12931-022-02142-2. |
Anti γH2AX antibody staining solution及びSecondary antibody staining solutionは保存できますか?
保存はできません。その日のうちにご使用ください。
抗体をキット付属のBlocking Solution以外の溶液で希釈してもいいですか?
キット付属のBlocking Solutionでの希釈をお勧めします。
他の溶液で希釈をするとバックグラウンドが上昇する可能性があります。
多重染色時の注意点はありますか?
本キットではマウス由来の一次抗体を使用しているため、他抗原を同時染色する場合にはマウス由来以外の一次抗体を選択ください。
組織染色時の注意点はありますか?
組織染色の際、マウス組織は使用できませんのでご注意ください。
マウス組織を染色すると、抗マウス抗体(蛍光標識二次抗体)がマウス組織中のIgGへ非特異吸着を起こし、バックグラウンドが上昇します。
<キットに含まれる抗体情報>
| 由来 | 交差性 | |
|---|---|---|
| 一次抗体 | マウス | ヒト、マウス |
| 蛍光標識二次抗体 | ヤギ | マウスIgG |


| 保存条件: 冷蔵 , 取扱条件: 吸湿注意 |

この製品に関連する研究では、下記の関連製品も使われています。
Cellular Senescence Detection Kit – SPiDER-βGal
Cellular Senescence Plate Assay Kit – SPiDER-βGal
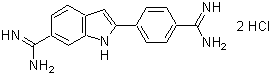
–Cellstain®– DAPI solution
上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 DNA Damage Detection Kit – γH2AX - Deep Red
DNA Damage Detection Kit – γH2AX - Deep Red
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 set | ¥37,700 | 347-09441 |
| 1 set | ・Anti γH2AX antibody ・Secondary antibody – Deep Red ・Blocking Solution |
×1 ×1 22 ml×1 |
|---|


DNA ダメージにより二重鎖切断が生じると、ヒストンタンパク質の一種であるH2AX が速やか、かつ広範囲にわたってリン酸化されます。リン酸化H2AX(γH2AX) は、DNA ダメージの鋭敏なマーカーであることから、化学物質や活性酸素、紫外線や放射線などの遺伝毒性及び発がん性評価への応用が期待されています。また、γH2AX の検出は近年では細胞老化を評価する指標としても知られています。
本製品はモノクローナル抗体研究所製の抗γH2AX 抗体を使用しています。
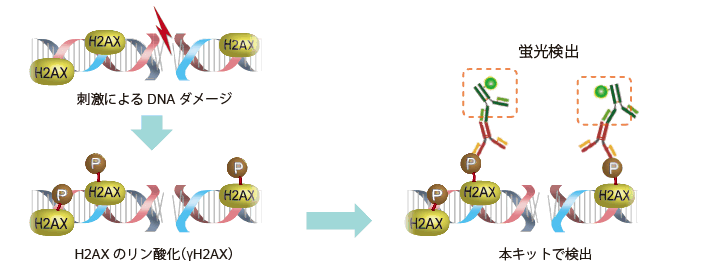
Anti γH2AX antibody staining solution及びSecondary antibody staining solutionは保存できますか?
保存はできません。その日のうちにご使用ください。
抗体をキット付属のBlocking Solution以外の溶液で希釈してもいいですか?
キット付属のBlocking Solutionでの希釈をお勧めします。
他の溶液で希釈をするとバックグラウンドが上昇する可能性があります。
多重染色時の注意点はありますか?
本キットではマウス由来の一次抗体を使用しているため、他抗原を同時染色する場合にはマウス由来以外の一次抗体を選択ください。
組織染色時の注意点はありますか
組織染色の際、マウス組織は使用できませんのでご注意ください。
マウス組織を染色すると、抗マウス抗体(蛍光標識二次抗体)がマウス組織中のIgGへ非特異吸着を起こし、バックグラウンドが上昇します。
<キットに含まれる抗体情報>
| 由来 | 交差性 | |
|---|---|---|
| 一次抗体 | マウス | ヒト、マウス |
| 蛍光標識二次抗体 | ヤギ | マウスIgG |


| 保存条件: 冷蔵 , 取扱条件: 吸湿注意 |

この製品に関連する研究では、下記の関連製品も使われています。
Cellular Senescence Detection Kit – SPiDER-βGal

Cellular Senescence Plate Assay Kit – SPiDER-βGal
–Cellstain®– DAPI solution
上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 2,3-Diaminonaphthalene(for NO detection)
2,3-Diaminonaphthalene(for NO detection)
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 10 mg | ¥6,800 | 341-07021 |
・本製品を粉末の状態で取り出し使用する場合、性状の性質上、静電気等の要因で容器内に付着し、取り出しにくい場合があります。
・容器内に付着し、取り出せなかった粉末に関しては、使用する溶媒を容器に入れ、溶かし出して使用してください。
| 性状: | 本品は、白色~淡黄褐色粉末で、熱水、熱アルコール及び希塩酸等に溶ける。 |
|---|---|
| 希塩酸溶状: | 試験適合 |
| 融点: | 185~200℃ |
| NO測定適合性: | 試験適合 |
| IRスペクトル: | 試験適合 |
| 保存条件: 冷凍,遮光 |

上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 ECGreen-Endocytosis Detection
ECGreen-Endocytosis Detection
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 40 μl | ¥48,200 | 342-09751 |
<使用回数の目安> 40 μl あたり、35 mm dish 20 枚、μ-Slide 8 well 20 枚



技術情報の目次
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) | 細胞 (HepG2) |
蛍光顕微鏡 | Y. Miyakawa, M. Otsuka, K. Sekiba, K. Funato, K. Koike, "Humanized virus-suppressing factor inhibits hepatitis B virus infection by targeting viral cell entry ", Heliyon, 2021, doi:10.1016/j.heliyon.2021.e07586. |
| 2) | 細胞 (皮膚線維芽細胞) |
蛍光顕微鏡 | H. L. Marko, N. C. Hornig, R. C. Betz, P. Holterhus, J. Altmüller, H. Thiele, M. Fabiano, H. Schweikert, D. Braun, Ul Schiweizer, "Genomic variants reducing expression of two endocytic receptors in 46,XY differences of sex development", Hum. Mutat. 2022, doi:10.1002/humu.24325. |
| 3) | 細胞 (HeLa) |
蛍光顕微鏡 | K. Qiu, R. Seino, G. Han, M. Ishiyama, Y. Ueno, Z. Tian, Y. Sun, J. Diao, "De Novo Design of A Membrane-Anchored Probe for Multidimensional Quantification of Endocytic Dynamics", Adv. Healthcare Mater., 2022, doi:10.1002/adhm.202102185. |
落射型顕微鏡でも観察できますか。
共焦点顕微鏡での観察を推奨しておりますが、落射型顕微鏡でも観察は可能です。
小社ではDAPI filter set (Ex : 360/40 nm, Em : 460/50 nm)で検出した実績があります。
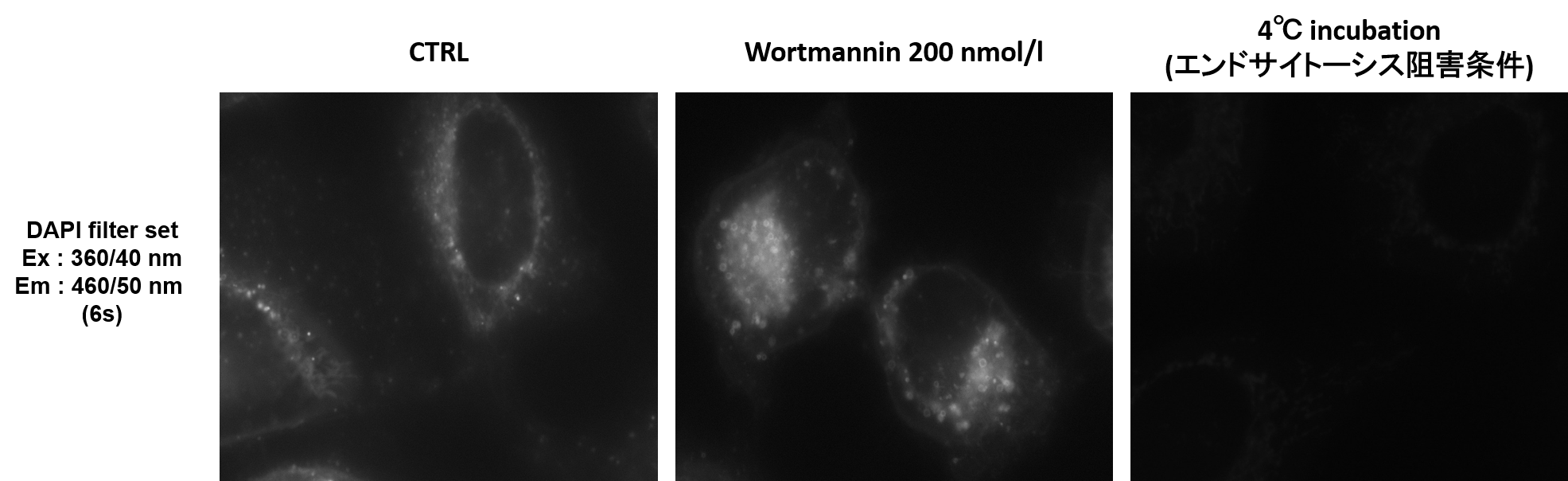
図1. 落射型顕微鏡での観察
血清含有培地で染色できますか?
血清含有培地での染色も可能です。
HeLa細胞では血清含有培地で作成したworking solutionを用いて24時間まで細胞毒性なく染色した実績があります。
細胞毒性の評価は小社製品「 Cell Counting Kit-8 」を用いて確認しています。
|
図. Cell Counting Kit-8を用いた細胞毒性試験(24時間) |


| 性状: | 黄緑色液体 |
|---|---|
| 含量: | 試験適合 |
| 保存条件: 冷凍 | |
| 危険・有害 シンボルマーク |
 |
|---|---|

この製品に関連する研究では、下記の関連製品も使われています。
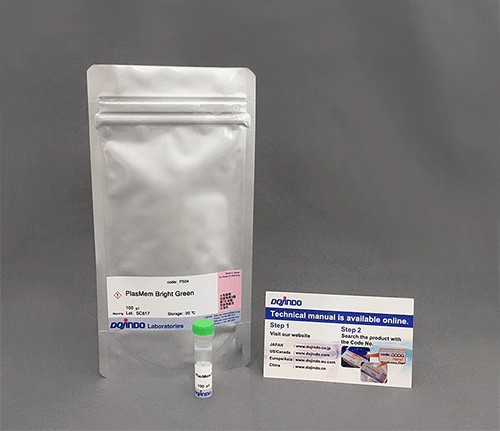
PlasMem Bright Green
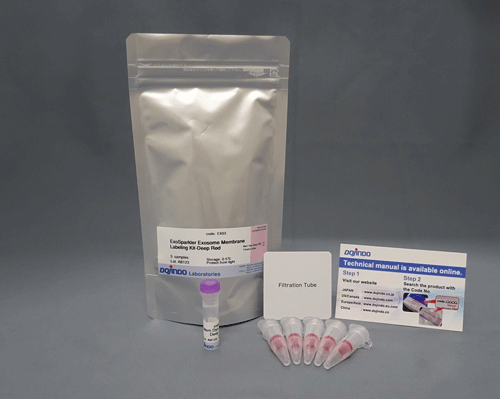
ExoSparkler Exosome Membrane Labeling Kit-Deep Red
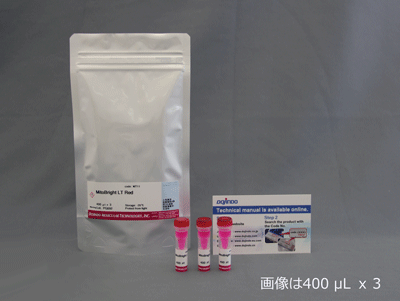
MitoBright LT Red

DALGreen – Autophagy Detection
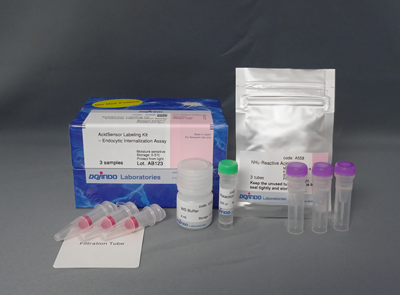
AcidSensor Labeling Kit Endocytic Internalization Assay
上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 Mitophagy Detection Kit
Mitophagy Detection Kit
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 set | ¥40,900 | 344-91901 |
| 1 set | ・Mtphagy Dye ・lyso Dye |
5 μg x 1 30 μg x 1 |
|---|




Mtphagy Dyeによるマイトファジー検出機構
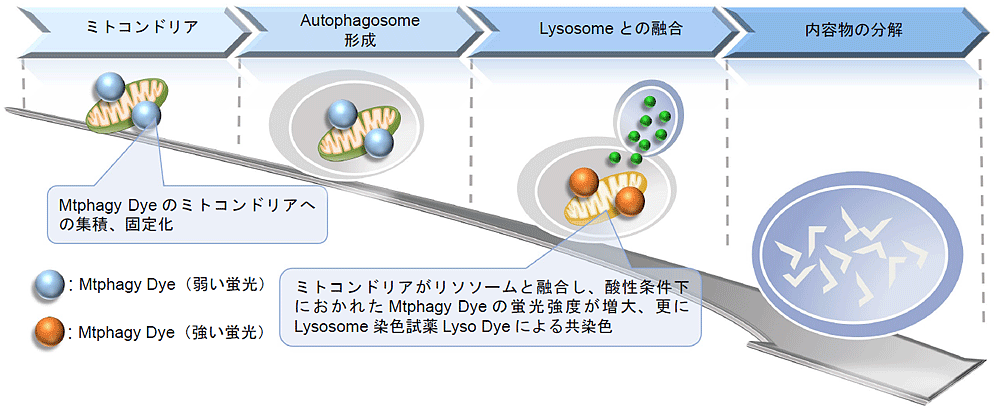
本製品の測定原理・使用例が記載された論文は、参考文献4)をご覧ください。
HeLa細胞をCCCP処理し、マイトファジー検出試薬(MtphagyDye)及びミトコンドリア染色試薬(MitoBright LT Green)にて共染色しタイムラプス撮影(6時間)しました。
|
<検出条件> |
長期滞留性・血清培地中で使用可能
【ミトコンドリア染色試薬】
・MitoBright LT Green
・MitoBright LT Red
・MitoBright LT Deep Red
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) |
細胞(HeLa) |
フローサイトメーター | J. Koniga, C. Otta, M. Hugoa, T. Junga, A. L. Bulteaub, T. Grunea and A. Hohna, "Mitochondrial contribution to lipofuscin formation", Redox Biology, 2017, 11, 673. |
| 2) | 細胞(KB) | 蛍光顕微鏡 | K. Kameyama, "Induction of mitophagy-mediated antitumor activity with folate-appended methyl-β-cyclodextrin", International Journal of Nanomedicine, 2017, 12, 3433. |
| 3) |
細胞(SH-SY5Y, 初代ラット皮質神経細胞) |
蛍光顕微鏡 | E. F. Fang, T. B. Waltz, H. Kassahun, Q. Lu, J. S. Kerr, M. Morevati, E. M. Fivenson, B. N. Wollman, K. Marosi, M. A. Wilson, W. B. Iser, D. M. Eckley, Y. Zhang, E. Lehrmann, I. G. Goldberg, M. S. Knudsen, M. P. Mattson, H. Nilsen, V. A. Bohr and K. G. Becker, "Tomatidine enhances lifespan and healthspan in C. elegans through mitophagy induction via the SKN-1/Nrf2 pathway", Scientific Reports, 2017, 7, (46208), DOI: 10.1038/srep46208. |
| 4) | 細胞(HeLa、Parkin発現HeLa) | 蛍光顕微鏡 | H. Iwashita, S. Torii, N. Nagahora, M. Ishiyama, K. Shioji, K. Sasamoto, S. Shimizu and K. Okuma, "Live Cell Imaging of Mitochondrial Autophagy with a Novel Fluorescent Small Molecule", ACS Chem. Biol., 2017, 12, (10), 2546. |
| 5) |
細胞(Cardiomyocytes) |
フローサイトメーター | Y. Feng, NB. Madungwe, CV. da Cruz Junho and JC. Bopassa, "Activation of G protein-coupled oestrogen receptor 1 at the onset of reperfusion protects the myocardium against ischemia/reperfusion injury by reducing mitochondrial dysfunction and mitophagy.", Br. J. Pharmacol., 2017, 174, (23), 4329. |
| 6) |
細胞(HCT116) |
蛍光顕微鏡 | K. M. Elamin, K. Motoyama, T. Higashi, Y. Yamashita, A. Tokuda and H. Arima, "Dual targeting system by supramolecular complex of folate-conjugated methyl-β-cyclodextrin with adamantane-grafted hyaluronic acid for the treatment of colorectal cancer.", Int. J. Biol. Macromol., 2018, doi: 10.1016/j.ijbiomac.2018.02.149. |
| 7) |
細胞(Parkin-HeLa) |
プレートリーダー | N. Furuya, S. Kakuta, K. Sumiyoshi, M. Ando, R. Nonaka, A. Suzuki, S. Kazuno, S. Saiki and N. Hattori, "NDP52 interacts with mitochondrial RNA poly(A) polymerase to promote mitophagy.", EMBO Rep. ., 2018, doi: 10.15252/embr.201846363. |
| 8) |
細胞(NKT) |
フローサイトメーター | L. Zhu, X. Xie, L. Zhang, H. Wang, Z. Jie, X. Zhou, J. Shi, S. Zhao, B. Zhang, X. Cheng and S. Sun, "TBK-binding protein 1 regulates IL-15-induced autophagy and NKT cell survival", Nature Communications., 2018, 9, (1), doi:10.1038/s41467-018-05097-5. |
| 9) |
細胞(HeLa) |
フローサイトメーター | K. Araki, K. Kawauchi, W. Sugimoto, D. Tsuda, H. Oda, R. Yoshida and K. Ohtani, "Mitochondrial protein E2F3d, a distinctive E2F3 product, mediates hypoxia-induced mitophagy in cancer cells", Commun Biol., 2019, DOI: 10.1038/s42003-018-0246-9. |
| 10) |
細胞(Bovine Sertoli) |
蛍光顕微鏡 | E. Adegoke, S. Adeniran, Y. Zeng, X. Wang, H. Wang, C. Wang, H. Zhang, P. Zheng and G. Zhang , "Pharmacological inhibition of TLR4/NF-κB with TLR4-IN-C34 attenuated microcystin-leucine arginine toxicity in bovine Sertoli cells.", J Appl Toxicol., 2019,doi: 10.1002/jat.3771. |
| 11) |
組織(マウス) |
蛍光顕微鏡 | E. F. Fang, Y. Hou, K. Palikaras, B. A. Adriaanse, J. S. Kerr, B. Yang, S. Lautrup, M. M. Hasan-Olive, D. Caponio, X. Dan, P. Rocktaschel, D. L. Croteau, M. Akbari, N. H. Greig, T. Fladby, H. Nilsen, M. Z. Cader, M. P. Mattson, N. Tavernarakis and V. A. Bohr, "Mitophagy inhibits amyloid-β and tau pathology and reverses cognitive deficits in models of Alzheimer's disease.", Nat. Neurosci. ., 2019,DOI:10.1038/s41593-018-0332-9. |
| 12) |
細胞(HepG2) |
蛍光顕微鏡 | Iwasawa, T. Shinomiya, N. Ota, N. Shibata, K. Nakata, I. Shiina, and Y. Nagahara , "Novel Ridaifen-B Structure Analog Induces Apoptosis and Autophagy Depending on Pyrrolidine Side Chain", Biological and Pharmaceutical Bulletin., 2019, 42, (3), 401-410, doi: 10.1248/bpb.b18-00643. |
| 13) |
細胞(U2OS) |
蛍光顕微鏡 プレートリーダー |
T. Namba, "BAP31 regulates mitochondrial function via interaction with Tom40 within ER-mitochondria contact sites ", Sci Adv., 2019, 5, (6), 1386. |
| 14) | 細胞(ラット:INS-1) | 蛍光顕微鏡 | A. Inamura, S. M. Hirayama, and K. Sakurai, Loss of Mitochondrial DNA by Gemcitabine Triggers Mitophagy and Cell Death', Biol. Pharm. Bull.., 2019, 42, 1977. |
| 15) |
細胞(HRCEpiC, HRPTEpic) |
プレートリーダー | Y. Zhao and M. Sun, Metformin rescues Parkin protein expression and mitophagy in high glucose-challenged human renal epithelial cells by inhibiting NF-κB via PP2A activation., Life Sci.., 2020, DOI:10.1016/j.lfs.2020.117382. |
| 16) |
細胞(RAES) |
蛍光顕微鏡 | N. Liu, J. Wu, L. Zhang, Z. Gao, Y. Sun, M. Yu, Y. Zhao, S. Dong, F. Lu and W. Zhang , "Hydrogen Sulphide modulating mitochondrial morphology to promote mitophagy in endothelial cells under high‐glucose and high‐palmitate ", J. Cell. Mol. Med., 2017, 21, (12), 3190. |
| 17) |
細胞(BAECs) |
蛍光顕微鏡 | N. Kajihara, D. Kukidome, K. Sada, H. Motoshima, N. Furukawa, T. Matsumura, T. Nishikawa and E. Araki, "Low glucose induces mitochondrial reactive oxygen species via fatty acid oxidation in bovine aortic endothelial cells", J Diabetes Investig, 2017, 8, (6), 750. |
| 18) |
細胞(HT22) |
蛍光顕微鏡 | M. Jin, H. Ni and L. Li, "Leptin Maintained Zinc Homeostasis Against Glutamate-Induced Excitotoxicity by Preventing Mitophagy-Mediated Mitochondrial Activation in HT22 Hippocampal Neuronal Cells.", Front Neurol, 2018, 9, (9), 332. |
| 19) |
細胞(BMDMs) |
フローサイトメーター | D. Bhatia, K. P. Chung, K. Nakahira, E. Patino, M. C. Rice, L. K. Torres, T. Muthukumar, A. M. Choi, O. M. Akchurin and M. E. Choi , "Mitophagy-dependent macrophage reprogramming protects against kidney fibrosis", JCI Insight, 2019, 4, (23), e132826. |
| 20) |
細胞(U2OS) |
蛍光顕微鏡 | J. Zheng, D. L. Croteau, V. A. Bohr and M. Akbari, "Diminished OPA1 expression and impaired mitochondrial morphology and homeostasis in Aprataxin-deficient cells. ", Nucleic Acids Res., 2019, 47, (8), 4086. |
| 21) |
細胞(HT22) |
蛍光顕微鏡 | D. D. Wang, M. F. Jin, D. J. Zhao and H. Ni, "Reduction of Mitophagy-Related Oxidative Stress and Preservation of Mitochondria Function Using Melatonin Therapy in an HT22 Hippocampal Neuronal Cell Model of Glutamate-Induced Excitotoxicity", Front Endocrinol (Lausanne), 2019, 10, 550. |
| 22) |
細胞(CD4+T-cells, HeLa) |
蛍光顕微鏡 フローサイトメーター |
A. Bektas, S. H. Schurman, M. G. Freire, A. Bektas, S. H. Schurman, M. G. Freire, C. A. Dunn, A. K. Singh, F. Macian, A. M. Cuervo, R. Sen and L. Ferrucci, "Age-associated changes in human CD4+ T cells point to mitochondrial dysfunction consequent to impaired autophagy.", Aging (Albany NY)., 2019, 11, (21), 9234-9263. |
| 23) |
細胞(ALM) |
フローサイトメーター | T. Nechiporuk, S.E. Kurtz, O. Nikolova, T. Liu, C.L. Jones, A. D. Alessandro, R. C. Hill, A. Almeida, S. K. Joshi, M. Rosenberg, C. E. Tognon, A. V. Danilov, B. J. Druker, B. H. Chang, S. K McWeeney and J. W. Tyner, "The TP53 Apoptotic Network Is a Primary Mediator of Resistance to BCL2 Inhibition in AML Cells.", Cancer Discov., 2019, 9, (7), 919. |
| 24) |
細胞(PK-15) |
蛍光顕微鏡 | Y. Zhang, R. Sun, X. Li and W. Fang, "Porcine Circovirus 2 Induction of ROS Is Responsible for Mitophagy in PK-15 Cells via Activation of Drp1 Phosphorylation", Viruses., 2020, 12, (3), 289. |
| 25) |
細胞(HCE) |
蛍光顕微鏡 | Y. Huo, W. Chen, X. Zheng, J. Zhao, Q. Zhang, Y. Hou, Y. Cai, X. Lu and X. Jin , "The protective effect of EGF-activated ROS in human corneal epithelial cells by inducing mitochondrial autophagy via activation TRPM2.", J. Cell. Physiol., 2020, DOI: 10.1002/jcp.29597. |
| 26) |
細胞(ラット:心筋細胞) |
蛍光顕微鏡 | Y. Sun, F. Lu, X. Yu, B. Wang, J. Chen, F. Lu, S. Peng, X. Sun, M. Yu, H. Chen, Y. Wang, L. Zhang, N. Liu, H. Du, D. Zhao and W. Zhang, "Exogenous H2S Promoted USP8 Sulfhydration to Regulate Mitophagy in the Hearts of db/db Mice.", Aging Dis., 2020, 11, (2), 269. |
| 27) |
細胞(HCFs) |
蛍光顕微鏡 | R. Tanaka, M. Umemura, M. Narikawa, M. Hikichi, K. Osaw, T. Fujita, U. Yokoyama, T. Ishigami, K. Tamura and Y. Ishikawa, "Reactive fibrosis precedes doxorubicin-induced heart failure through sterile inflammation.", ESC Heart Fail., 2020, 7, (2), 588. |
| 28) |
細胞(VSMCs) |
蛍光顕微鏡 | C. Duan, L. Kuang, X. Xiang, J. Zhang, Y. Zhu, Y. Wu, Q. Yan, L. Liu and T. Li, "Drp1 regulates mitochondrial dysfunction and dysregulated metabolism in ischemic injury via Clec16a-, BAX-, and GSH- pathways ", Cell Death Dis., 2020, 11, 251. |
| 29) |
細胞(Bovine Sertoli) |
蛍光顕微鏡 | E. O. Adegoke, W. Xue, N. S. Machebe, S. O. Adeniran, W. Hao, W. Chen, Z. Han, Z. Guixue and Z. Peng, "Sodium Selenite inhibits mitophagy, downregulation and mislocalization of blood-testis barrier proteins of bovine Sertoli cell exposed to microcystin-leucine arginine (MC-LR) via TLR4/NF-kB and mitochondrial signaling pathways blockage.", Ecotoxicol. Environ. Saf., 2018, 116, 165. |
| 30) |
細胞(HeLa) |
蛍光顕微鏡 | D. Takahashi, J. Moriyama, T. Nakamura, E. Miki, E. Takahashi, A. Sato, T. Akaike, K. I. Nakama and H. Arimoto, "AUTACs: Cargo-Specific Degraders Using Selective Autophagy. ", Mol. Cell, 2019, 76, (5), 797. |
| 31) |
細胞(primary hepatocyte) |
蛍光顕微鏡 | H. Kim, J. H. Lee and J. W. Park, "IDH2 deficiency exacerbates acetaminophen hepatotoxicity in mice via mitochondrial dysfunction-induced apoptosis.", Biochim Biophys Acta Mol Basis Dis, 2019, 1865, (9), 2333. |
| 32) |
細胞(C3H10T1/2s) |
蛍光顕微鏡 | M. S. Rahman and Y. S. Kim, "PINK1-PRKN mitophagy suppression by Mangiferin promotes a brown-fat-phenotype via PKA-p38 MAPK signalling in murine C3H10T1/2", Metabolism, 2020, 101, 154228. |
| 33) |
細胞(NHEKs) |
蛍光顕微鏡 | S. Ikeoka and A. Kiso , "The Involvement of Mitophagy in the Prevention of UV-B-Induced Damage in Human Epidermal Keratinocytes ", J. Soc. Cosmet. Chem. Jpn., 2020, 54(3), 252. |
| 34) | 細胞(MIN6-M9) | 蛍光顕微鏡 | R. Inoe, T. Tsuno, Y. Togashi, T. Okuyama, A. Sato, K. Nishiyama, M. Kyohara, J. Li, S. Fukushima, T. Kin, D. Miyashita, Y. Shiba, Y. Atobe, H. Kiyonari, K. Bando, A. S. Shapiro, K. Funakoshi, R. N. Kulkarni, Y. Terauchi, and J. Shirakawa, "Uncoupling protein 2 and aldolase B impact insulin release by modulating mitochondrial function and Ca2+ release from the ER", 2022, iScience, doi:10.1016/j.isci.2022.104603. |
既存法に対する利点を教えてください。
pHセンサーKeimaタンパク質を用いた検出方法と比較して、本キットは低分子蛍光試薬を用いるため、蛍光タンパク質を発現させる必要がありません。また、一般的なライブセルイメージング用の蛍光試薬と同様の操作方法で染色、観察することができます。
DMSO stock solutionは、どのくらい安定ですか?
Mtphagy Dye、Lyso Dyeともに、調製後、-20℃で保存してください。調製後1か月間安定です。使用量に応じて小分けして保存することをお勧めします。
Working solutionは、どのくらい安定ですか?
保存できません。用時調製してください。
培地中のフェノールレッドは測定に影響しますか?
観察する際、共焦点レーザー顕微鏡をご使用であれば殆どフェノールレッドの影響はありませんが、落射型蛍光顕微鏡をご使用の場合はフェノールレッドによるバックグラウンドが観察されます。(下記観察データを参照)そのため落射型蛍光顕微鏡をご使用になる際は、Working solutionまたは染色時にはフェノールレッド不含の培地またはHBSSをご使用ください。
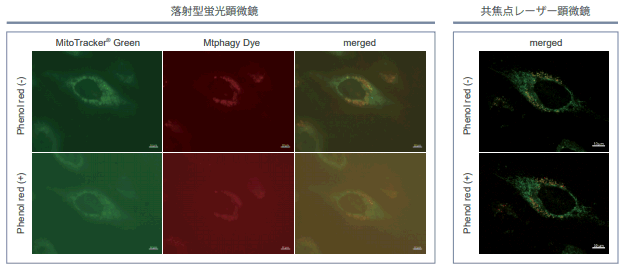
蛍光顕微鏡の推奨フィルターを教えてください。
各試薬に応じて以下のフィルターを推奨します。
Mtphagy Dye: 励起(500~560 nm)、蛍光(670~730 nm)
Lyso Dye: 励起(350~450 nm)、蛍光(500~560 nm)
取扱説明書の「励起/蛍光スペクトル」及び「蛍光顕微鏡による測定例」もご参考ください。
多重染色時の注意点を教えてください。
Mtphagy Dyeは一般的なRed系の蛍光色素に比べストークスシフトが長いため、Deep Redの蛍光色素と共染色する時には特に注意が必要です。
つまりMtphagy Dyeは500–560 nmで励起し、670-730 nmで蛍光を検出するため、Deep Redの蛍光検出波長と重なります。そのため、Deep Redの色素が励起されない波長でMtphagy Dyeを励起し、一方でMtphagy Dyeが励起されない波長でDeep Redの色素を励起する必要があります。
[漏れ込みの事例]
① MitoBright Deep Redのみを添加した細胞(Mtphagy Dyeは添加していない条件)を用意した。
② MitoBright Deep Redの励起・蛍光波長で観察し、蛍光が観察されるかを確認した(下右図)。
③ Mtphagy Dyeの励起・蛍光波長で観察し、蛍光が観察されるかを確認した(下左図)。
④ ③にてMitoBright Deep Red由来の蛍光が観察された(下左図)。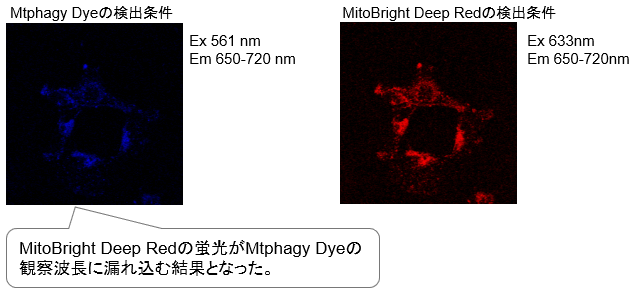
※上記の様に蛍光の漏れ込みが確認された場合、下記をご参照ください。
[漏れ込み時の対処法]
○励起フィルター変更による対処
上記の確認例にある通りEx 561 nmではMitoBright Deep Redも励起されていることから、Mtphagy Dyeの励起波長をより500 nmに近いレーザーまたはフィルターに変更しMitoBright Deep Redが励起されない条件に設定する。
○励起強度および蛍光検出感度の調整による対処
MitoBright Deep Redの蛍光がMtphagy Dyeの観察波長に漏れ込んでいる場合、蛍光が観察されないレベルまで励起強度または観察時の感度を下げる。
その後、変更したそれぞれの観察条件でMtphagy Dyeの蛍光が検出できることを確認する。
[漏れ込みの確認方法]
Mtphagy Dye、Lyso Dye(リソソーム染色試薬)、MitoBright Deep Red(ミトコンドリア染色試薬)を用いた三重染色時の確認
1. 細胞を3つのdishまたはwellに準備する。
(Mtphagy Dye、Lyso Dye、MitoBright Deep Redは、それぞれ異なるdishまたはwell中の細胞に加え染色する)
2. Mtphagy DyeおよびMitoBright Deep Redをそれぞれの細胞に添加する。(血清不含培地中)
3. 37℃で30分間培養する。
4. マイトファジー誘導条件(飢餓培養など)にて培養する。
5. Lyso Dyeを上記2.で使用していない細胞へ添加する。(血清不含培地中)
6. 37℃で30分間培養する。
7. それぞれの試薬に滴した励起波長、蛍光波長で観察する。
8. 使用している試薬以外の観察波長で、蛍光の漏れ込みがないことを確認する。
[観察条件]
Lyso Dye:Ex 350-450 nm、Em 500-560 nm
Mtphagy Dye: Ex 500-560 nm、Em 670-730 nm
MitoBright Deep Red: Ex 640 nm、Em 656-700 nm


| 性状: | |
|---|---|
| Mtphagy Dye: | 試験適合 |
| Lyso Dye: | 試験適合 |
| 保存条件: 冷蔵,遮光 , 取扱条件: 窒素置換,吸湿注意 |

この製品に関連する研究では、下記の関連製品も使われています。

Mtphagy Dye
MitoBright LT Green
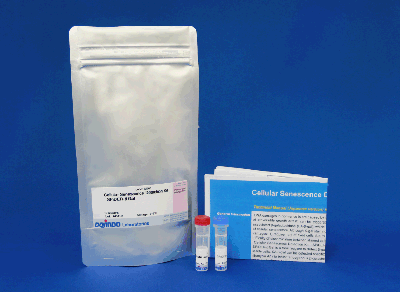
Cellular Senescence Detection Kit – SPiDER-βGal
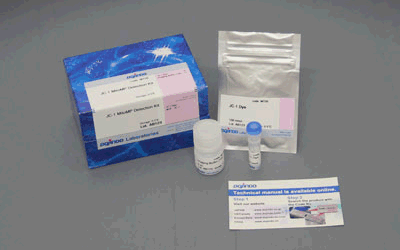
JC-1 MitoMP Detection Kit
上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 JC-1 MitoMP Detection Kit
JC-1 MitoMP Detection Kit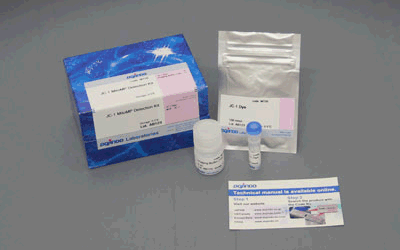
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 set | ¥25,500 | 349-09401 |
| 1 set | JC-1 Dye Imaging Buffer (10x) |
100 nmol x1 11 ml x1 |
|---|
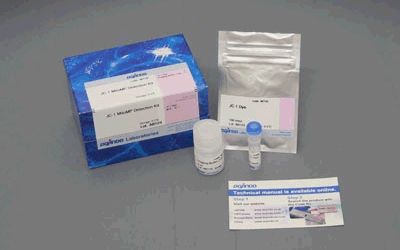


技術情報の目次
細胞周期のG2/M 期に作用して細胞増殖を停止させ、細胞老化を誘導することが知られているDoxorubicin(DOX) をA549 細胞へ添加後、Cell Cycle Assay Solution Blue (製品コード:C549)/ Deep Red(製品コード:C548)でA549 細胞における細胞周期の変化と、Cellular Senescence Detection Kit – SPiDER-βGal(製品コード:SG03)で細胞老化、本製品でミトコンドリア膜電位の変化を確認しました。
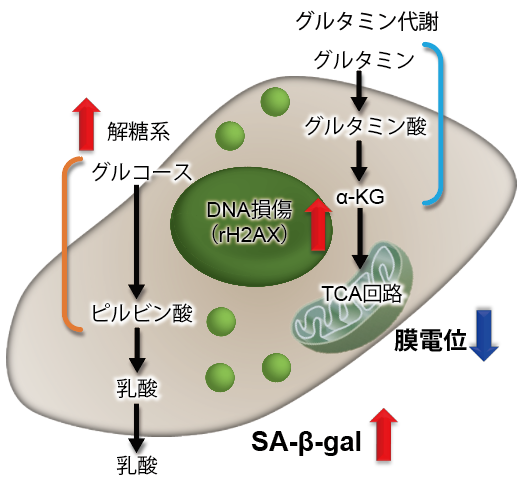
|

Cell Cycle Assay Solution Blue
Cellular Senescence Detection Kit – SPiDER-βGal
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1 | 細胞 (A549) |
蛍光顕微鏡 | K. Li, S. Sun, L. Xiao and Z. Zhang,"Bioactivity-guided fractionation of Helicteres angustifolia L. extract and its molecular evidence for tumor suppression", Front Cell Dev Biol.,2023, doi: 10.3389/fcell.2023.1157172. |
| 2 | 細胞 (A549) |
フローサイトメーター | C. N. D’Alessandro-Gabazza, T. Yasuma, T. Kobayashi, M. Toda1, A. M. Abdel-Hamid, H. Fujimoto, O. Hataji, H. Nakahara, A. Takeshita, K. Nishihama, T. Okano, H. Saiki, Y. Okano, A. Tomaru, V. F. D’Alessandro, M. Shiraishi, A. Mizoguchi, R. Ono, J. Ohtsuka, M. Fukumura, T. Nosaka, X. Mi, D. Shukla, K. Kataoka, Y. Kondoh, M. Hirose, T. Arai, Y. Inoue, Y. Yano, R. I. Mackie, I. Cann and E. C. Gabazza, "Inhibition of lung microbiota-derived proapoptotic peptides ameliorates acute exacerbation of pulmonary fibrosis", Nat. Comm., 2022, doi:10.1038/s41467-022-29064-3. |
| 3 | 細胞 (A549, HeLa) |
プレートリーダー | J. Yang, L. Liu, Y. Oda, K. Wada, M. Ago, S. Matsuda, M. Hattori, T. Goto, Y. Kawashima, Y. Matsuzaki and T. Taketani,"Highly-purified rapidly expanding clones, RECs, are superior for functional-mitochondrial transfer", Stem Cell Res Ther., 2023, doi: 10.1186/s13287-023-03274-y. |
| 4 | 細胞 (ALM) |
プレートリーダー | T. Nechiporuk, S.E. Kurtz, O. Nikolova, T. Liu, C.L. Jones, A. D. Alessandro, R. C. Hill, A. Almeida, S. K. Joshi, M. Rosenberg, C. E. Tognon, A. V. Danilov, B. J. Druker, B. H. Chang, S. K McWeeney and J. W. Tyner , "The TP53 Apoptotic Network Is a Primary Mediator of Resistance to BCL2 Inhibition in AML Cells.", Cancer Discov, 2019, 9, |
| 5 | 細胞 (ARPE-19) |
フローサイトメーター、 蛍光顕微鏡 |
J. Hamuro, T. Yamashita, Y. Otsuki, N. Hiramoto, M. Adachi, T. Miyatani, H. Tanaka, M. Ueno, S. Kinoshita and C. Sotozono,"Spatiotemporal Coordination of RPE Cell Quality by Extracellular Vesicle miR-494-3p Via Competitive Interplays With SIRT3 or PTEN", Invest Ophthalmol Vis Sci., 2023, doi: 10.1167/iovs.64.5.9. |
| 6 | 細胞 (ARPE-19) |
蛍光顕微鏡 | J. H. Quan, F. F. Gao, H. A. Ismail, J. M. Yuk, G. H. Cha, J. Q. Chu and Y. H. Lee, "Silver Nanoparticle-Induced Apoptosis in ARPE-19 Cells Is Inhibited by Toxoplasma gondii Pre-Infection Through Suppression of NOX4-Dependent ROS Generation", Int J Nanomedicine., 2020, 15, 3695–3716. |
| 7 | 細胞 (C2C12 myocytes) |
– | Z. Jing, T. Iba, H. Naito, P. Xu, J.I. Morishige, N. Nagata, H. Okubo and H.Ando ,"L-carnitine prevents lenvatinib-induced muscle toxicity without impairment of the anti-angiogenic efficacy", Front Pharmacol., 2023, doi: 10.3389/fphar.2023.1182788. |
| 8 | 細胞 (C2C12, 3T3L1) |
プレートリーダー | M. Kurano, K. Tsukamoto, T. Shimizu, H. Kassai, K. Nakao, A. Aiba, M. Hara and Yatomi , "Protection Against Insulin Resistance by Apolipoprotein M/Sphingosine 1-Phosphate ", Diabetes, 2020, DOI: 10.2337/db19-0811. |
| 9 | 細胞 (Colon 26) |
蛍光顕微鏡 | B. Uranbileg, M. Kurano, K. Kano, E. Sakai, J. Arita, K. Hasegawa, T. Nishikawa, S. Ishihara, H. Yamashita, Y. Seto, H. Ikeda, J. Aoki and Y. Yatomi,"Sphingosine 1‐phosphate lyase facilitates cancer progression through converting sphingolipids to glycerophospholipids", Clin Transl Med., 2022, doi: 10.1002/ctm2.1056. |
| 10 | 組織 (Frozen heart slides) |
蛍光顕微鏡 | W. Yu, Y. Hu, Z. Liu, K. Guo, D. Ma, M. Peng, Y. Wang, J. Zhang, X. Zhang, P. Wang, J. Zhang, P. Liu and J. Lu,"Sorting nexin 3 exacerbates doxorubicin-induced cardiomyopathy via regulation of TFRC-dependent ferroptosis", Acta Pharmaceutica Sinica B., 2023, doi: https://doi.org/10.1016/j.apsb.2023.08.016. |
| 11 | 細胞 (HCE) |
蛍光顕微鏡 | T. Yamashita, K. Asada, M. Ueno, N. Hiramoto, T. Fujita, M. Toda, C. Sotozono, S. Kinoshita and J. Hamuro,"Cellular interplay through extracellular vesicle miR-184 alleviates corneal endothelium degeneration", Ophthalmol Sci., 2022, doi: 10.1016/j.xops.2022.100212. |
| 12 | 細胞 (HCE) |
蛍光顕微鏡 | M. Ueno, K Yoshii, T. Yamashita, K. Sonomura, K. Asada, E. Ito, T. Fujita, C. Sotozono, S. Kinoshita and J. Hamuro,"The Interplay Between Metabolites and MicroRNAs in Aqueous Humor to Coordinate Corneal Endothelium Integrity", Ophthalmol Sci., 2023, doi: 10.1016/j.xops.2023.100299. |
| 13 | 細胞 (HCE-T) |
– | W. Otsu, T. Yako, E. Sugisawa, S. Nakamura, H. Tsusaki, N. Umigai, M. Shimazawa and H. Hara,"Crocetin protects against mitochondrial damage induced by UV-A irradiation in corneal epithelial cell line HCE-T cells", J Pharmacol Sci., 2022, doi: 10.1016/j.jphs.2022.10.005. |
| 14 | 細胞 (HCE-T) |
蛍光顕微鏡 | K. Ishida, T. Yako, M. Tanaka, W. Otsu, S. Nakamura, M. Shimazawa, H. Tsusaki and H. Hara,"Free-radical scavenger NSP-116 protects the corneal epithelium against UV-A and blue led light exposure", Biol Pharm Bull., 2021, doi: 10.1248/bpb.b21-00017. |
| 15 | 細胞 (HepG) |
蛍光顕微鏡、 分光光度計 |
M. Ikura, K. Furuya, T. Matsuda and T. Ikura,"Impact of Nuclear De Novo NAD+ Synthesis via Histone Dynamics on DNA Repair during Cellular Senescence To Prevent Tumorigenesis", Mol Cell Biol., 2022, doi: 10.1128/mcb.00379-22. |
| 16 | 細胞 (hiPSCs, Neurons) |
蛍光顕微鏡 | T. Hara, M. Toyoshima, Y. Hisano, S. Balan, Y. Iwayama, H. Aono,Y. Futamura, H. Osada, Y. Owada and T. Yoshikawa,"Glyoxalase I disruption and external carbonyl stress impair mitochondrial function in human induced pluripotent stem cells and derived neurons", Translational Psychiatry., 2021, doi: 10.1038/s41398-021-01392-w. |
| 17 | 細胞 (HSCs; LX-2,T6) |
蛍光顕微鏡 | Y. Su, S. Lu, C. Hou, K. Ren, M. Wang, X. Liu, S. Zhao and X. Liu ,"Mitigation of liver fibrosis via hepatic stellate cells mitochondrial apoptosis induced by metformin", International Immunopharmacology., 2022, doi: 10.1016/j.intimp.2022.108683. |
| 18 | 細胞 (HUVECs) |
蛍光顕微鏡 | D. Ueno, K. Ikeda, E. Yamazaki, A. Katayama, R. Urata and S. Matoba ,"Spermidine improves angiogenic capacity of senescent endothelial cells, and enhances ischemia-induced neovascularization in aged mice", Sci Rep., 2023, doi: 10.1038/s41598-023-35447-3. |
| 19 | 細胞 (KYSE30) |
蛍光顕微鏡 | Q. Luo, X. Wu, P. Zhao, Y. Nan, W. Chang, X. Zhu, D. Su and Z. Liu,"OTUD1 activates caspase‐independent and caspase‐dependent apoptosis by promoting AIF nuclear translocation and MCL1 degradation", Adv Sci (Weinh)., 2021, doi: 10.1002/advs.202002874. |
| 20 | 細胞 (Macrophage) | 蛍光顕微鏡 | G. Yang, M. Fan, J. Zhu, C. Ling, L. Wu, X. Zhang, M. Zhang, J. Li, Q. Yao, Z. Gu and X. Cai, "A multifunctional anti-inflammatory drug that can specifically target activated macrophages massively deplete intracellular H2O2 and produce large amounts CO for a highly efficient treatment of osreoarthritis" , Biomaterials, 2020, doi:10.1016/j.biomaterials.2020.120155. |
| 21 | 細胞 (MDA-MB-415, MCF-7) |
蛍光顕微鏡 | S.Y. Park, K.J. Jeong, A. Poire, D. Zhang, Y.H. Tsang, A.S. Blucher and G.B. Mills ,"Irreversible HER2 inhibitors overcome resistance to the RSL3 ferroptosis inducer in non-HER2 amplified luminal breast cancer", Cell Death & Disease., 2023, doi: 10.1038/s41419-023-06042-1. |
| 22 | 細胞 (MIN6) |
プレートリーダー、 蛍光顕微鏡 |
N. Mizusawa, N. Harada, T. Iwata, I. Ohigashi, M. Itakura and K. Yoshimoto,"Identification of protease serine S1 family member 53 as a mitochondrial protein in murine islet beta cells", Islets., 2022, doi: 10.1080/19382014.2021.1982325. |
| 23 | 細胞 (MSCs) |
フローサイトメーター | S.Y. Jo, H.J. Cho and T.M. Kim,"Fenoldopam mesylate enhances the survival of mesenchymal stem cells under oxidative stress and increases the therapeutic function in acute kidney injury", Cell Transplant., 2023, doi: 10.1177/09636897221147920. |
| 24 | 細胞 (Neuro-2A) |
蛍光顕微鏡、 プレートリーダー |
Y. Wang, Y. Shinoda, A. Cheng, I. Kawahata and K. Fukunaga,"Epidermal fatty acid-binding protein 5 (FABP5) Involvement in alpha-synuclein-induced mitochondrial injury under oxidative stress", Biomedicines., 2021, doi: 10.3390/biomedicines9020110. |
| 25 | 細胞 (Neuron) |
蛍光顕微鏡 | I. Kawahata, L. Luc Bousset, R. Melki and K. Fukunaga , "Fatty Acid-Binding Protein 3 is Critical for α-Synuclein Uptake and MPP+-Induced Mitochondrial Dysfunction in Cultured Dopaminergic Neurons ", Int J Mol Sci., 2019, 20, 5358. |
| 26 | 細胞 (Neuron) |
蛍光顕微鏡 | A. Fukuda, S. Nakashima,Y. Oda, K. Nishimura, H. Kawashima, H. Kimura, T. Ohgita, E. Kawashita, K. Ishihara, A. Hanaki, M. Okazaki, E. Matsuda, Y. Tanaka, S. Nakamura, T. Matsumoto, S. Akiba, H. Saito, H. Matsuda and K. Takata,"Plantainoside B in Bacopa monniera Binds to Aβ Aggregates Attenuating Neuronal Damage and Memory Deficits Induced by Aβ", Biol Pharm Bull., 2023, doi: 10.1248/bpb.b22-00797. |
| 27 | 細胞 (PAECs) |
プレートリーダー | T. Sakai, H. Takagaki, N. Yamagiwa, M. Ui, S. Hatta and J. Imai,"Effects of the cytoplasm and mitochondrial specific hydroxyl radical scavengers TA293 and mitoTA293 in bleomycin-induced pulmonary fibrosis model mice", Antioxidants (Basel)., 2021, doi: 10.3390/antiox10091398. |
| 28 | 細胞 (PANC-1) |
プレートリーダー | W.A. Naime, A. Kimishima, A. Setiawan, J.R. Fahim, M.A. Fouad, M.S. Kamel and M. Arai,"Mitochondrial Targeting in an Anti-Austerity Approach Involving Bioactive Metabolites Isolated from the Marine-Derived Fungus Aspergillus sp.", Marine drugs., 2020, doi: 10.3390/md18110555. |
| 29 | 細胞 (PANC-1, MIAPaca-2) |
蛍光顕微鏡 | T. Taniai, Y. Shirai,Y. Shimada, R. Hamura, M. Yanagaki, N. Takada, T. Horiuchi, K. Haruki, K. Furukawa, T. Uwagawa, K. Tsuboi, Y. Okamoto, S. Shimada, S. Tanaka, T. Ohashi and T. Ikegami,"Inhibition of acid ceramidase elicits mitochondrial dysfunction and oxidative stress in pancreatic cancer cells", Cancer Sci., 2021, doi: 10.1111/cas.15123. |
| 30 | 細胞 (PC) |
フローサイトメーター | R. Hamura, Y. Shirai,Y. Shimada, N. Saito, T. Taniai, T. Horiuchi, N. Takada, Y. Kanegae, T. Ikegami, T. Ohashi and K. Yanaga ,"Suppression of lysosomal acid alpha‐glucosidase impacts the modulation of transcription factor EB translocation in pancreatic cancer", Cancer Sci., 2021, doi: 10.1111/cas.14921. |
| 31 | 細胞 (porcine oocytes) |
蛍光顕微鏡 | W. Hu, Y. Zhang, D. Wang, T. Yang, J. Qi, Y. Zhang, H. Jiang, J Zhang, B. Sun and S. Liang,"Iron Overload-Induced Ferroptosis Impairs Porcine Oocyte Maturation and Subsequent Embryonic Developmental Competence in vitro", Front Cell Dev Biol., 2021, doi: 10.3389/fcell.2021.673291. |
| 32 | 細胞 (porcine oocytes) |
蛍光顕微鏡 | Y. Xiao, B. Yuan, W. Hu, J. Qi, H. Jiang, B. Sun, J. Zhang and S. Liang,"Tributyltin Oxide Exposure During in vitro Maturation Disrupts Oocyte Maturation and Subsequent Embryonic Developmental Competence in Pigs", Front Cell Dev Biol., 2021, doi: 10.3389/fcell.2021.683448. |
| 33 | 細胞 (RGC-5) |
プレートリーダー | Y. Aoyama, S. Inagaki, K. Aoshima, Y. Iwata, S. Nakamura, H. Hara and M. Shimazawa,"Involvement of endoplasmic reticulum stress in rotenone-induced leber hereditary optic neuropathy model and the discovery of new therapeutic agents", J Pharmacol Sci . .,2021, doi: 10.1016/j.jphs.2021.07.003. |
| 34 | 細胞 (SAS,HSC-2) |
プレートリーダー | K. Yamana, J. Inoue, R. Yoshida, J. Sakata, H. Nakashima, H. Arita, S. Kawaguchi, S. Gohara, Y. Nagao, H. Takeshita, M. Maeshiro, R. Liu, Y. Matsuoka, M. Hirayama, K. Kawahara, M. Nagata, A. Hirosue, R. Toya, R. Murakami, Y. Kuwahara, M. Fukumoto and H. Nakayama,"Extracellular vesicles derived from radioresistant oral squamous cell carcinoma cells contribute to the acquisition of radioresistance via the miR‐503‐3p‐BAK axis", J Extracell Vesicles., 2021, doi: 10.1002/jev2.12169. |
| 35 | 細胞 (SBC-3) |
フローサイトメーター | N. Takahashi, T. Iguchi, M. Kuroda, M. Mishima and Y. Mimaki,"Novel Oleanane-Type Triterpene Glycosides from the Saponaria officinalis L. Seeds and Apoptosis-Inducing Activity via Mitochondria", Int J Mol Sci., 2022, doi: 10.3390/ijms23042047. |
| 36 | 細胞 (SH-SY5Y) |
蛍光顕微鏡 | Q. Guo, I. Kawahata, A. Cheng, H. Wang, W. Jia, H. Yoshino and K. Fukunaga,"Fatty acid-binding proteins 3 and 5 are involved in the initiation of mitochondrial damage in ischemic neurons", Redox Biology., 2023, doi: 10.1016/j.redox.2022.102547. |
| 37 | 細胞 (SiHa) |
蛍光顕微鏡 | F.F. Gao, J.H. Quan, M.A. Lee, W. Ye, J.M. Yuk, G.H. Cha, I.W. Choi and Y.H. Lee,"Trichomonas vaginalis induces apoptosis via ROS and ER stress response through ER–mitochondria crosstalk in SiHa cells", Parasites &vectors., 2021, doi: 10.1186/s13071-021-05098-2. |
| 38 | 細胞 (SU-DHL-2) |
フローサイトメーター | Q. Zhao, D. Jiang, X. Sun, Q. Mo, S. Chen, W. Chen, R. Gui and X. Ma, "Biomimetic nanotherapy: core–shell structured nanocomplexes based on the neutrophil membrane for targeted therapy of lymphoma", J Nanobiotechnology., 2021, doi: 10.1186/s12951-021-00922-4. |
| 39 | 細胞 (THP-1) |
蛍光顕微鏡 | W. Zheng, Z. Zhou, Y. Rui, R. Ye, F. Xia, F. Guo, X. Liu, J. Su, M. Lou, and X.F. Yu,"TRAF3 activates STING-mediated suppression of EV-A71 and target of viral evasion", Signal Transduct Target Ther., 2023, doi: 10.1038/s41392-022-01287-2. |
| 40 | 細胞 (TSM15) |
In Cell Analyzer | M. Honda, F. Shimizu, R. Sato, Y. Mizukami, K. Watanabe, Y. Takeshita, T. Maeda, M. Koga and T. Kanda,"Jo-1 Antibodies From Myositis Induce Complement-Dependent Cytotoxicity and TREM-1 Upregulation in Muscle Endothelial Cells", Neurol Neuroimmunol Neuroinflamm., 2023, doi: 10.1212/NXI.0000000000200116. |
| 41 | 細胞 (tumor) |
フローサイトメーター | H. Wang, X. Rong, G. Zhao, Y. Zhou, Y. Xiao, D. Ma, X. Jin, Y. Wu, Y. Yan, H. Yang, Y. Zhou, M. Qian, C. Niu, X. Hu, D.Q. Li, Q. Liu, Y. Wen, Y.Z. Jiang, C. Zhao and Z.M. Shao ,"The microbial metabolite trimethylamine N-oxide promotes antitumor immunity in triple-negative breast cancer", Cell Metab., 2022, doi: 10.1016/j.cmet.2022.02.010. |
| 42 | 細胞 (TY10) |
In Cell Analyzer | F. Shimizu, R. Ogawa, Y. Mizukami, K. Watanabe, K. Hara, C. Kadono, T. Takahashi, T. Misu, Y. Takeshita, Y. Sano, M. Fujisawa, T. Maeda, I. Nakashima, K. Fujihara and T. Kanda,"GRP78 antibodies are associated with blood-brain barrier breakdown in anti–myelin oligodendrocyte glycoprotein antibody–associated disorder", Neurol Neuroimmunol Neuroinflamm., 2022, doi: 10.1212/NXI.0000000000001038. |
| 43 | 細胞 (U2OS, HeLa) |
蛍光顕微鏡 | T. Namba, "BAP31 regulates mitochondrial function via interaction with Tom40 within ER-mitochondria contact sites ", Sci Adv., 2019, 5, (6), 1386. |
1キットあたりの使用回数の目安は?
目安となる使用回数の目安は、下記を参考にしてください。
| 装置 | 容器 | 回数 | 液量 |
|---|---|---|---|
| フローサイトメーター | - | 100回 | 0.5 ml/回 |
| 蛍光顕微鏡 マイクロプレートリーダー |
35 mm dish | 25 枚 | 2 ml/枚 |
| 8 well チャンバースライド | 30 枚 | 200 µl/well | |
| 96 well マイクロプレート | 5 枚 | 100 µl/well |
* 容器毎で使用する液量によって使用回数は変わります。容器と液量を予め確認の上、ご使用ください。
JC-1染色後の細胞の洗浄には、HBSSの代わりにPBSを使用できますか?
細胞へのダメージを軽減するため、HBSSの使用を推奨しております。HBSSがお手元にない場合は培地での洗浄を推奨します。
血清入り培地を使用してもいいですか?
細胞洗浄やWorking Solutionに血清入り培地を使用して頂いて構いません。蛍光観察時はImaging Bufferを推奨しますが、血清入り培地をご使用の場合はフェノールレッド不含培地を推奨します。
染色後の細胞固定化、または細胞固定化後の染色は可能ですか?
固定化によりミトコンドリアが脱分極するため、染色後の固定及び固定化後の染色は出来ません。
薬剤処理したサンプルをコントロールと比較したところ、赤と緑の両方の蛍光値が増加(又は減少)しました。 結果をどのように解釈すればよいのでしょうか?
赤色と緑色の蛍光比を比較してください。
薬剤処理サンプルとコントロールの各々で赤色蛍光値/緑色蛍光値の比を算出してください。
両者を比較して蛍光比が低い程ミトコンドリア膜電位が低下していると考えられます。
(赤/緑の比で評価する理由)
JC-1は膜電位依存的に細胞に蓄積するため、細胞の状態により細胞あたりのJC-1の濃度は異なる場合があります1)2)。(コントロールと薬剤処理サンプルでは細胞の状態が異なるため、JC-1の蓄積濃度が異なります。)
また、JC-1はミトコンドリア膜電位が高い状態では凝集し緑から赤色に蛍光がシフトします。この凝集体の量は膜電位の程度に依存する3)ことから、赤/緑の比でサンプル間のミトコンドリア膜電位を比較することができます。
<参考文献>
1) Cossarizza, A. et al., Biochem Biophys Res Commun., 1993, 197(1), 40.
2) Perelman, A. et al., Cell Death and Disease, 2012, 3, e430
3) Smiley, S. T. et al., Proc. Nail. Acad. Sci., 1991, 88, 3671.


| 保存条件: 冷蔵 |

この製品に関連する研究では、下記の関連製品も使われています。
ROS Assay Kit -Photo-oxidation Resistant DCFH-DA-

mtSOX Deep Red – Mitochondrial Superoxide Detection
MT-1 MitoMP Detection Kit

Mitophagy Detection Kit
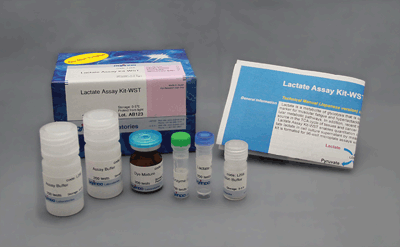
Lactate Assay Kit-WST
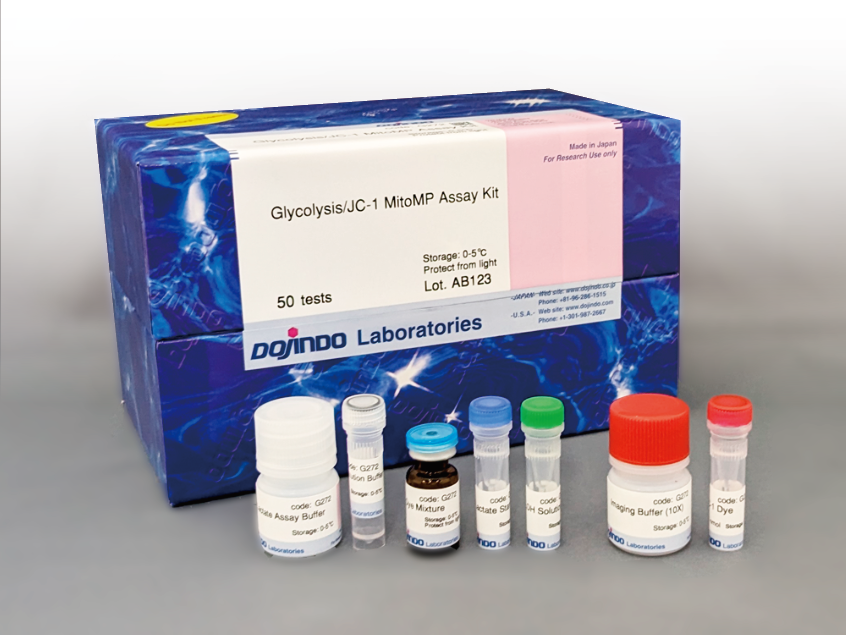
Glycolysis/JC-1 MitoMP Assay Kit
上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 MT-1 MitoMP Detection Kit
MT-1 MitoMP Detection Kit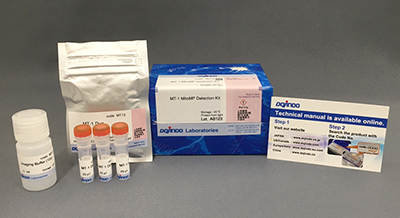
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 set | ¥30,000 | 343-09781 |
<使用回数の目安> 1 set あたり、35 mm dish 30 枚
| 1 set | MT-1 Dye Imaging Buffer (10x) |
20 μl ×3本 11 ml ×1本 |
|---|
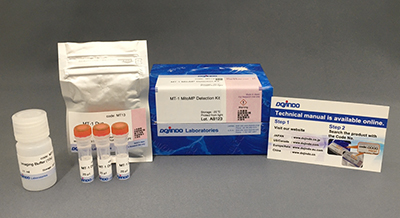
ミトコンドリア膜電位を観察する際、JC-1やTMRE、TMRMが使用されていますが、PFA固定不可、光退色などの試薬特性により、データの再現性に課題がありました。MT-1 MitoMP Detection Kitは、これらの課題を克服したミトコンドリア膜電位の検出キットです。
さらに、本キットに含まれる Imaging Bufferにより、蛍光バックグラウンドと細胞へのダメージを抑えた状態で観察することができます。
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1 | 細胞 (STHdh cell) |
蛍光顕微鏡 | N. Okada, T. Yako, S. Nakamura, M. Shimazawa, H. Hara, "Reduced mitochondrial complex II activity enhances cell death via intracellular reactive oxygen species in STHdhQ111 striatal neurons Q1 with mutant huntingtin", J. Pharmacol. Sci., 2021, doi:10.1016/j.jphs.2021.09.001. |
| 2 | 細胞 (膵臓癌細胞) |
蛍光顕微鏡 | N. Okuni, Y. Honma, T. Urano, K. Tamura, "Romidepsin and  cooperatively induce senescence of pancreatic cancer cells through downregulation of FOXM1 expression and induction of reactive oxygen species/lipid peroxidation", Mol. Biol. Rep., 2022, doi:10.1007/s11033-022-07192-9. cooperatively induce senescence of pancreatic cancer cells through downregulation of FOXM1 expression and induction of reactive oxygen species/lipid peroxidation", Mol. Biol. Rep., 2022, doi:10.1007/s11033-022-07192-9. |
| 3 | 細胞 (BM Cells) |
蛍光顕微鏡 | Y. Aoyagi, Y. Hayashi, Y. Harada, K. Choi, N. Matsumura, D. Sadato, Y. Maemoto, A. Ito, S. Yanagi, D. Starczynowski, H. Harada, "Mitochondrial Fragmentation Triggers Ineffective Hematopoiesis in Myelodysplastic Syndromes", Cancer Discovery, 2022, doi:10.1158/2159-8290.CD-21-0032. |
| 4 | 細胞 (ハエの間接飛行筋肉細胞) |
蛍光顕微鏡 | N. Nozawa, M. Noguchi, K. Shinno, M. Tajima, S. Aizawa, T. Saito, A. Asada, T. Ishii, M. Ishizuka, K. Iijima and K. Ando, " acid and sodium ferrous citrate ameliorate muscle aging and extend healthspan in Drosophila", FEBS Open Bio, 2022, doi:10.1002/2211-5463.13338. acid and sodium ferrous citrate ameliorate muscle aging and extend healthspan in Drosophila", FEBS Open Bio, 2022, doi:10.1002/2211-5463.13338. |
| 5 | 細胞 (悪性中皮腫細胞) |
蛍光顕微鏡 | Y. Sakai, M. Taguchi, Y. Morikawa, H. Miyazono, K. Suenami, Y. Ochiai, E. Yanase, T. Takayama, A. Ikari, T. Matsunaga, "Apoptotic mechanism in human brain microvascular endothelial cells triggered by 40-iodo-α-pyrrolidinononanophenone: Contribution of decrease in antioxidant properties", Toxicol. Lett., 2022, doi:10.1016/j.toxlet.2021.11.018. |
| 6 | 細胞 (MIN6-M9) |
蛍光顕微鏡 | R. Inoe, T. Tsuno, Y. Togashi, T. Okuyama, A. Sato, K. Nishiyama, M. Kyohara, J. Li, S. Fukushima, T. Kin, D. Miyashita, Y. Shiba, Y. Atobe, H. Kiyonari, K. Bando, A. S. Shapiro, K. Funakoshi, R. N. Kulkarni, Y. Terauchi, and J. Shirakawa, "Uncoupling protein 2 and aldolase B impact insulin release by modulating mitochondrial function and Ca2+ release from the ER", 2022, iScience, doi:10.1016/j.isci.2022.104603. |
| 7 | 細胞 (SH-SY5Y) |
フローサイトメーター | M. Hashimoto, M. Fujimoto, K. Konno, M. L. Lee, Y. Yamada, K. Yamashita, C. Toda, M. Tomura, M. Watanabe, O. Inanami and H. Kitamura, "Ubiquitin-Specific Protease 2 in the Ventromedial Hypothalamus Modifies Blood Glucose Levels by Controlling Sympathetic Nervous Activation", J. Neurosci., 2022, doi:10.1523/JNEUROSCI.2504-21.2022. |
| 8 | 細胞 (ヒト皮膚線維芽細胞) |
蛍光顕微鏡 | Y. Takeda and P. Dai, "Chronic Fatty Acid Depletion Induces Uncoupling Protein 1 (UCP1) Expression to Coordinate Mitochondrial Inducible Proton Leak in a Human-Brown-Adipocyte Model", 2022, doi:10.3390/cells11132038. |
| 9 | 細胞 (精子) | 蛍光顕微鏡 | A. Gotoh, M. Takeshima and K. Mizutani, "Near-anoxia induces immobilization and sustains viability of sperm stored in ant queens", Sci. Rep., 2023, doi:10.1038/s41598-023-29705-7. |
| 10 | 細胞 (髄核細胞) |
蛍光顕微鏡 (細胞数補正:Hoechst 33342) |
K. Suyama, D. Sakai, S. Hayashi, N. Qu, H. Terayama, D. Kiyoshima, K. Nagahori and M. Watanabe, "Bag-1 Protects Nucleus Pulposus Cells from Oxidative Stress by Interacting with HSP70", Biomedicines, 2023, doi:10.3390/biomedicines11030863. |
| 11 | 細胞 (HL60, KG1a) |
フローサイトメーター | K Kamachi, H Ureshino, T Watanabe,N Yoshida-Sakai,Y Fukuda-Kurahashi, K Kawasoe,T Hoshiko, Y Yamamoto, Y Kurahashi,and S Kimura , "Combination of a New Oral Demethylating Agent, OR2100, and Venetoclax for Treatment of Acute Myeloid Leukemia", Cancer Res Commun., 2023, doi:10.1158/2767-9764.CRC-22-0259. |
| 12 | 細胞 (RAW264) |
蛍光顕微鏡 | H. Gu, Y. Zhu, J. Yang, R. Jiang, Y. Deng, A. Li, Y. Fang, Q. Wu, H. Tu, H. Chang, J. Wen and X. Jiang, "Liver-Inspired Polyetherketoneketone Scaffolds Simulate Regenerative Signals and Mobilize Anti-Inflammatory Reserves to Reprogram Macrophage Metabolism for Boosted Osteoporotic Osseointegration", Adv sci, 2023, doi:10.1002/advs.202302136. |
タイムラプスイメージングする場合の注意点はありますか?
注意点として、励起光を最小限に抑え、検出感度を上げて撮影してください。
細胞への断続的な励起光の照射は、細胞へのダメージと蛍光色素の分解を引き起こす可能性がありますので、インターバルの時間などをご検討ください。
本品で染色後、細胞の固定化は可能ですか?
染色後、4% PFAで細胞を固定化できますが、膜透過処理は色素が漏れ出す原因となるためできません。
細胞を固定化後に染色することは可能ですか?
ミトコンドリア膜電位に依存してミトコンドリアに集積するため、固定化後の染色はできません。
蛍光強度を比較する場合のポジティブコントロールになる実験例はありますか?
ポジティブコントロールとして、取扱説明書にFCCP(carbonylcyanide-p-trifluoromethoxyphenylhydrazone)を用いた実験例を掲載しています。
染色条件を検討する場合、MT-1 Dyeはどれくらいの濃度で使用すればよいですか?
MT-1 Dyeの濃度は1000倍希釈での使用を推奨しておりますが、染色条件を最適化される場合は以下をご参考ください。
<蛍光強度が弱い場合>
500~1,000倍希釈の間でご検討ください。
<非特異吸着がみられる場合>
1,000~2,000倍希釈の間でご検討ください。
HBSSは どのようなものを使用すればよいですか?
フェノールレッドフリーのHBSS(+)をご使用ください。
(使用実績のあるHBSS)
製品名:HBSS(1x), メーカー:GIBCO, Code:14025-092
MT-1 working solutionの添加後、洗浄操作を行わずに観察できますか?
染色後は未洗浄でも観察可能ですが、未洗浄での長時間観察は細胞毒性を生じる可能性があるため、お勧めしません。
上澄みを除いて、ご使用の培地へ置換することをお勧めします。
MT-1 working solutionの調製にバッファーは使用できますか?
Hanks’ HEPES やHBSSが使用可能です。また、10 % FBS含有MEM、RPMI、MEMを用いて調製することもできます。
MT-1で染色後の洗浄には、HBSSの代わりにPBSを使用できますか?
細胞へのダメージを軽減するため、HBSSの使用を推奨しております。
HBSSがお手元にない場合は培地での洗浄をお勧めします。


| 保存条件: 冷凍,遮光 | |
| 危険・有害 シンボルマーク |
 |
|---|---|

この製品に関連する研究では、下記の関連製品も使われています。
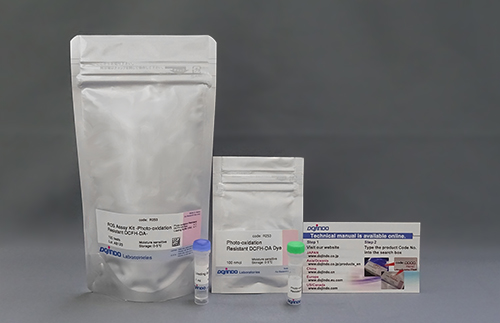
ROS Assay Kit -Photo-oxidation Resistant DCFH-DA-

mtSOX Deep Red – Mitochondrial Superoxide Detection
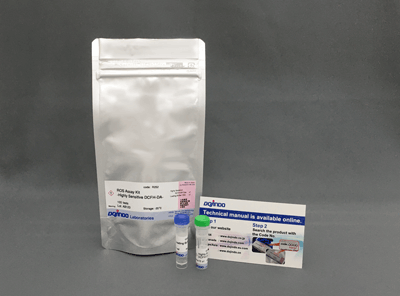
ROS Assay Kit -Highly Sensitive DCFH-DA-
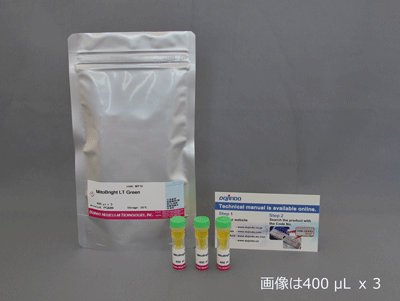
MitoBright LT Green

Mitophagy Detection Kit
上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 Lysosomal Acidic pH Detection Kit
Lysosomal Acidic pH Detection Kit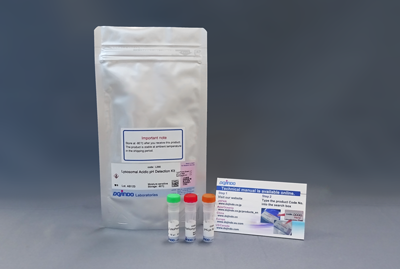
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 set | ¥38,000 | 346-10021 |
<使用回数の目安> 1 tube あたり、35 mm dish 10 枚、μ-Slide 8 well 10 枚、96-well Plate 2 枚
<保存上の注意>
・長期間の保存は、-80℃以下または液体窒素中での保存が望ましい。
・本製品は冷凍(-20℃)条件下でも経時的に劣化する。
-80℃以下での保存が難しい場合は、できるだけ早く使用すること。
・凍結・解凍の繰り返しは、劣化を促すので避けること。
| 1 set | LysoPrime Green pHLys Red Bafilomycin A1 |
x 1 x 1 x1 |
|---|
リソソームは細胞内小器官の一つで生体膜に囲まれた酸性小胞であり、 様々な分解酵素を内包しています。リソソー ムの役割は不要な物質を分解することであり、生体内恒常性の維持に寄与しています。 リソソームの機能不全は神経変性疾患等の発 症 ・ 進展に深く関与していることから、リソソームを詳細に解析することは病態の解明や治療薬の開発に非常に重要です。既存の色素を使用し機能を解析した場合、単一の色素の蛍光輝度のみで議論するため、リソソームの量が変動したのか、機能(pH)が変動したのかを判別するが困難でした。
本キットは、リソソームpHに依存的な蛍光の変動を示すpHLys Redと非依存的なLysoPrime Greenの2種類の色素を同梱しております。これらを組み合わせてリソソーム量とpHを同時解析することで、リソソーム機能の詳細な解析が可能です。さらに、リソソーム酸性化阻害剤 Bafilomycin A1を同梱しており、初めて実験される方でもネガティブコントロールが容易に取得することが可能です。
本キットでできるリソソーム機能解析概略
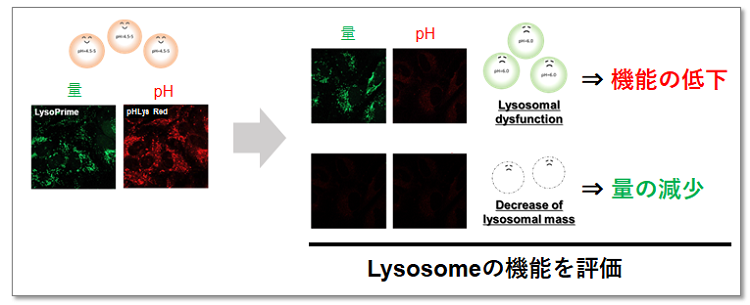
リソソームpH依存型色素 pHLys Redの染色メカニズム
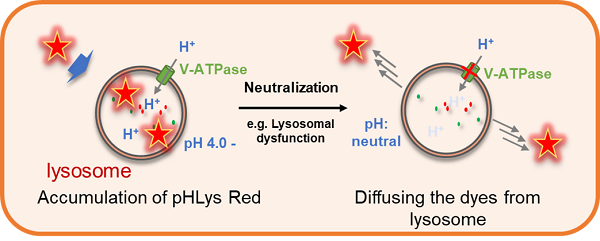
リソソームpH非依存型色素 LysoPrime Greenの染色メカニズム
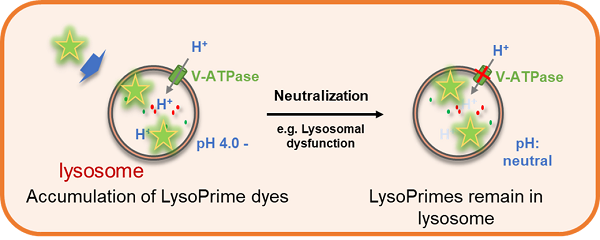
輸送温度と保存温度(-80℃)が異なっていたのですが性能は問題ないのでしょうか。
本品は冷凍 (-20℃) で輸送されますが、輸送に想定される期間で製品性能に影響を与える劣化や分解はございません。お手元に届き次第、-80℃にて保存して下さい。
また、-80℃保存が必須となるコンポーネントLysoPrime Greenについて、保存温度の違い (25℃、4℃、 -20℃、-80℃) による染色能への影響は、小社webサイトの製品ページ (品コード: L261)のFAQに掲載しております。LysoPrime Greenを室温 (25℃) で一ヶ月間保存した場合でも、リソソームの染色性能に影響がないことを確認しています。
リソソームpHに影響を与える薬剤刺激を考えています。注意点を教えてください。
LysoPrime Greenの染色は、必ず薬剤刺激前に行ってください。また、pHLys Redの染色は、必ずLysoPrime Green染色後に行ってください。
キット同梱のBafilomycin A1 (リソソーム酸性化阻害剤) を用いた刺激方法は、pHLys Red working solutionにBafilomycin A1を添加し染色と刺激を同時に行うか、pHLys Red working solutionで染色後にBafilomycin A1で刺激を行ってください。
血清含有培地で染色できますか。
LysoPrime Greenは血清の影響を受けるため染色できません。必ずHBSSや無血清培地等の血清を含まない溶液でworking solutionを作成してください。
pHLys Redは染色可能です。培地以外でしたらHBSSやPBSをご使用いただけます。
落射型顕微鏡でも観察できますか?
落射型顕微鏡でも観察は可能ですが、細胞によっては、確認が困難な場合があります。
その際は、共焦点顕微鏡で観察されることをお勧めします。
染色条件を検討する場合、LysoPrime GreenおよびpHLys Redはどれくらいの濃度で使用すればよいですか?
染色条件を最適化される場合は以下をご参考ください。
・LysoPrime Green
<蛍光強度が弱い場合>
1,000~2,000倍希釈の間でご検討ください。
<非特異吸着がみられる場合>
2,000~4,000倍希釈の間でご検討ください。
・pHLys Red
<蛍光強度が弱い場合>
250~500倍希釈の間でご検討ください。


| 保存条件: 冷凍(-80℃) , 取扱条件: 吸湿注意 | |
| 危険・有害 シンボルマーク |
|
|---|---|

この製品に関連する研究では、下記の関連製品も使われています。
ROS Assay Kit -Photo-oxidation Resistant DCFH-DA-

ECGreen-Endocytosis Detection
LysoPrime Green – High Specificity and pH Resistance
PlasMem Bright Green
| 沙门氏菌 | ||||||
| 品牌 | Code No. | 产品名称 | 包装量 | 价格(元) | 说明书 | 数量 |
| Takara | CY205 | CycleavePCR™ Salmonella Detection Kit Ver.2.0 | 50 Rxns | ¥2,003 | |
  |
| Takara | RR264 | TaKaRa qPCR Salmonella Detection Kit China Standard | 50 Rxns | ¥1,550 | |
  |
| Takara | S018 | Primer Set SIN-1&2 | 1,000 pmol each | ¥1,432 | |
  |
| Takara | S019 | Primer Set STN-1&2 | 1,000 pmol each | ¥1,432 | |
  |
| ■ 制品列表 | ||||||||||
|
||||||||||
页面更新:2019-12-29 11:26:19
| Transgene Detection Primer Set for Real Time (Mouse) | ||||||
| 品牌 | Code No. | 产品名称 | 包装量 | 价格(元) | 说明书 | 数量 |
| Takara | 3788 | Transgene Detection Primer Set for Real Time (Mouse) | 100 Rxns each | ¥1,188 | |
  |
页面更新:2021-02-08 15:00:18