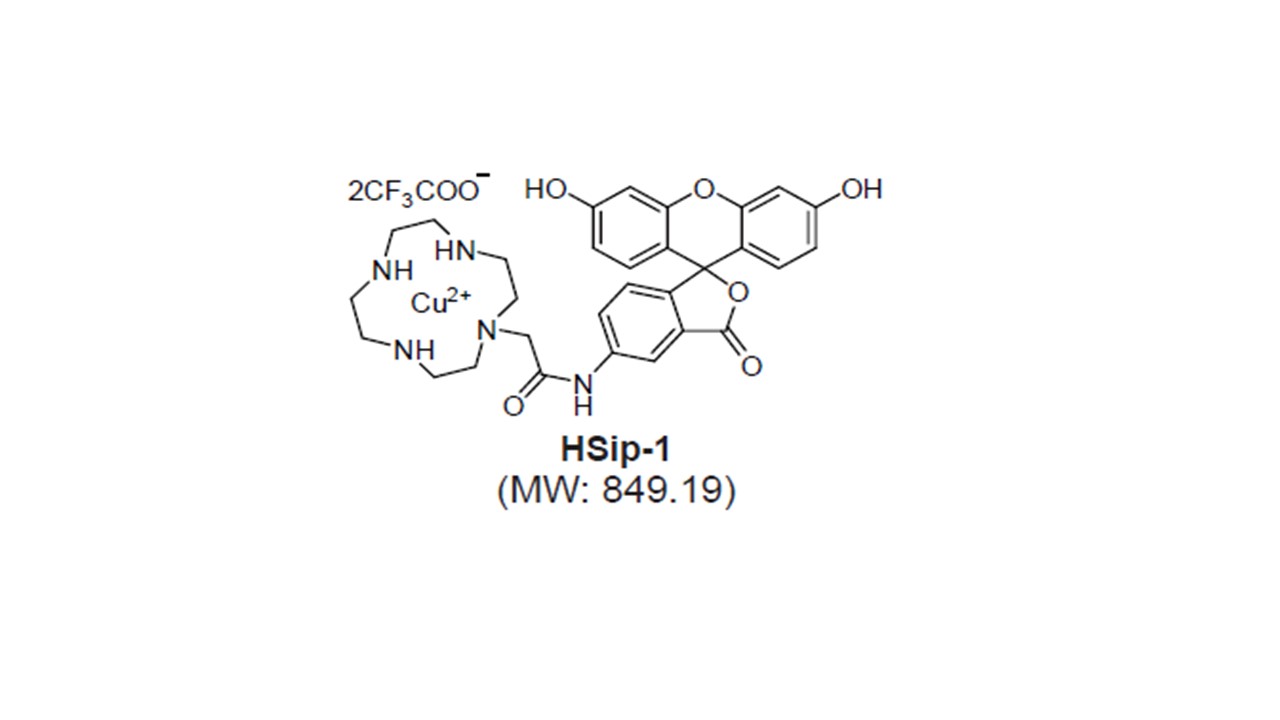
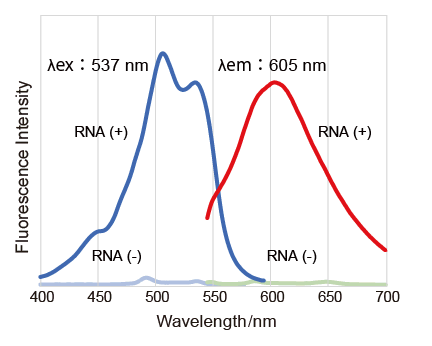
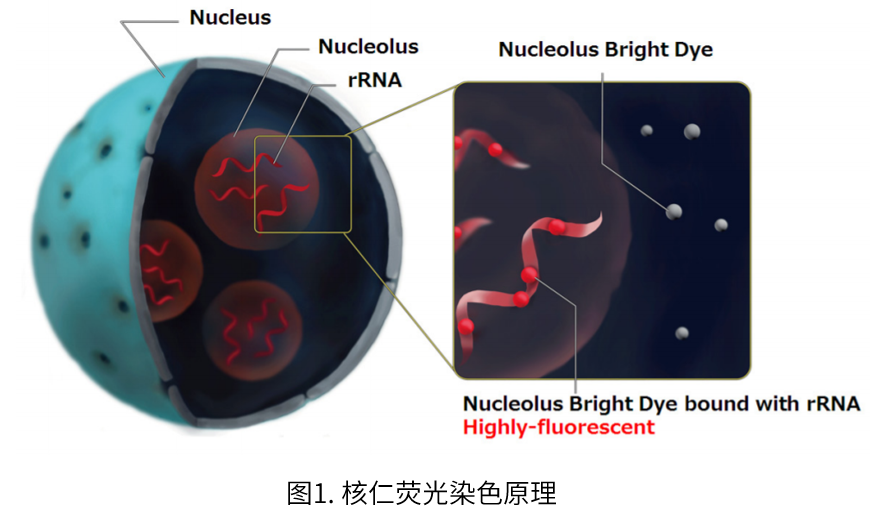
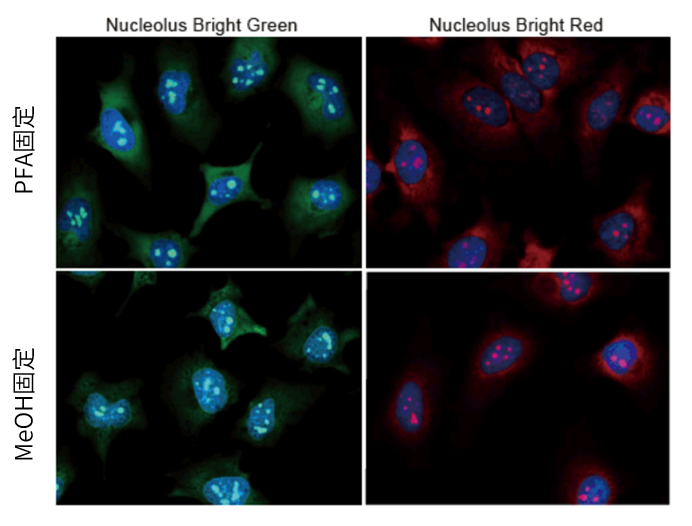
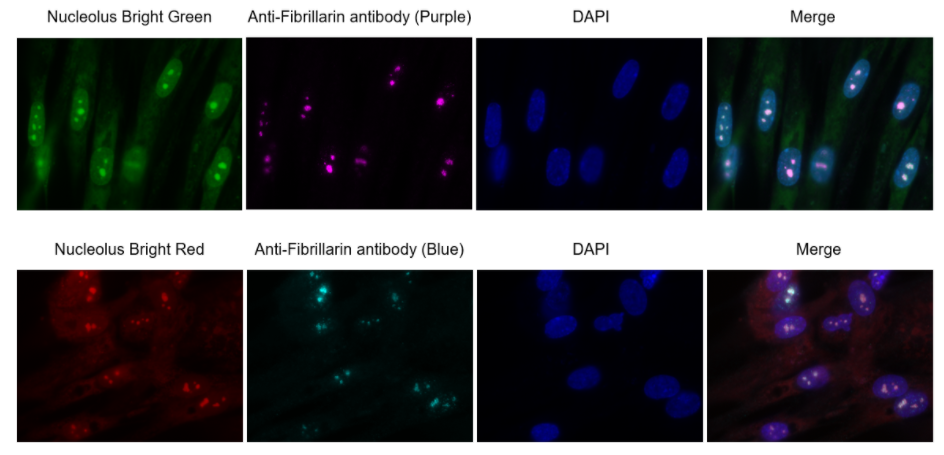
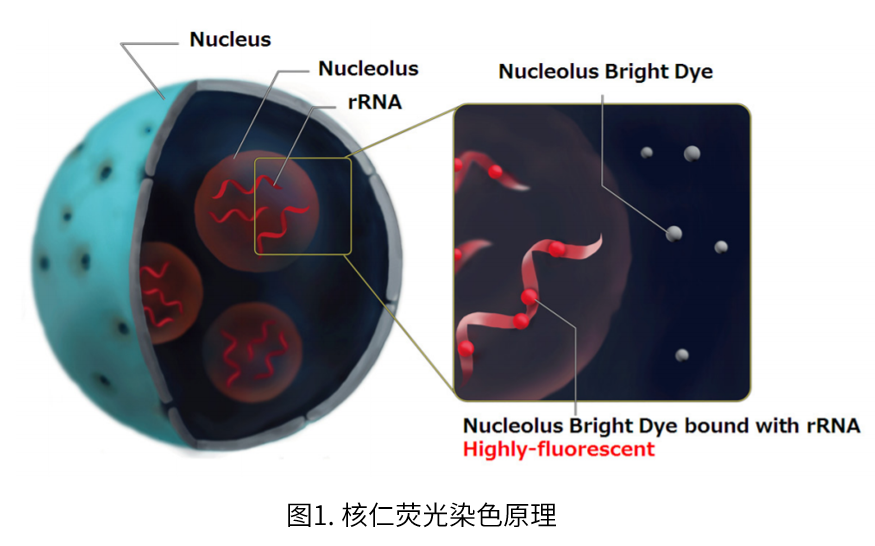
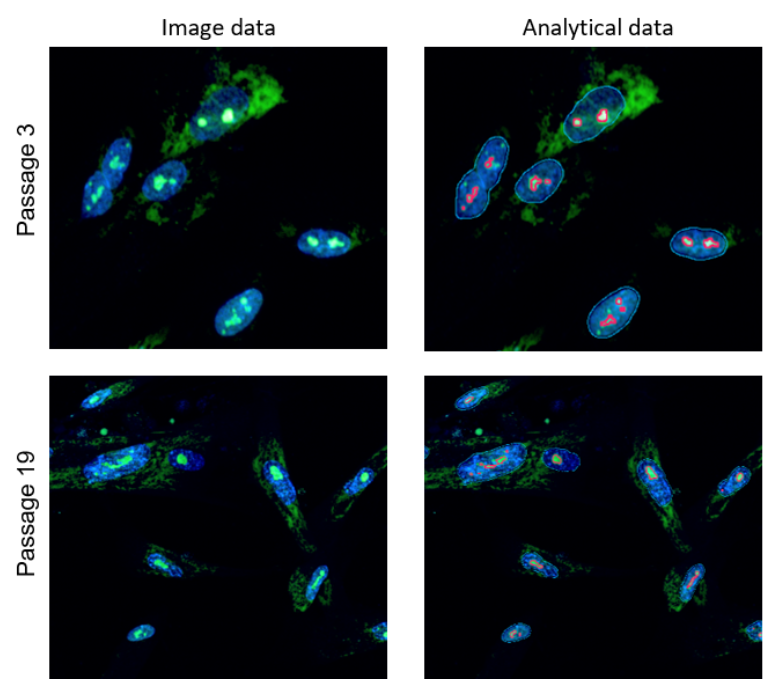
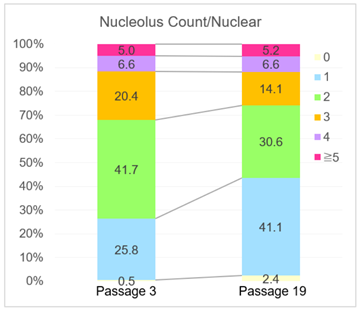
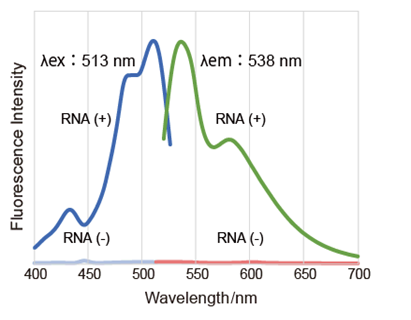
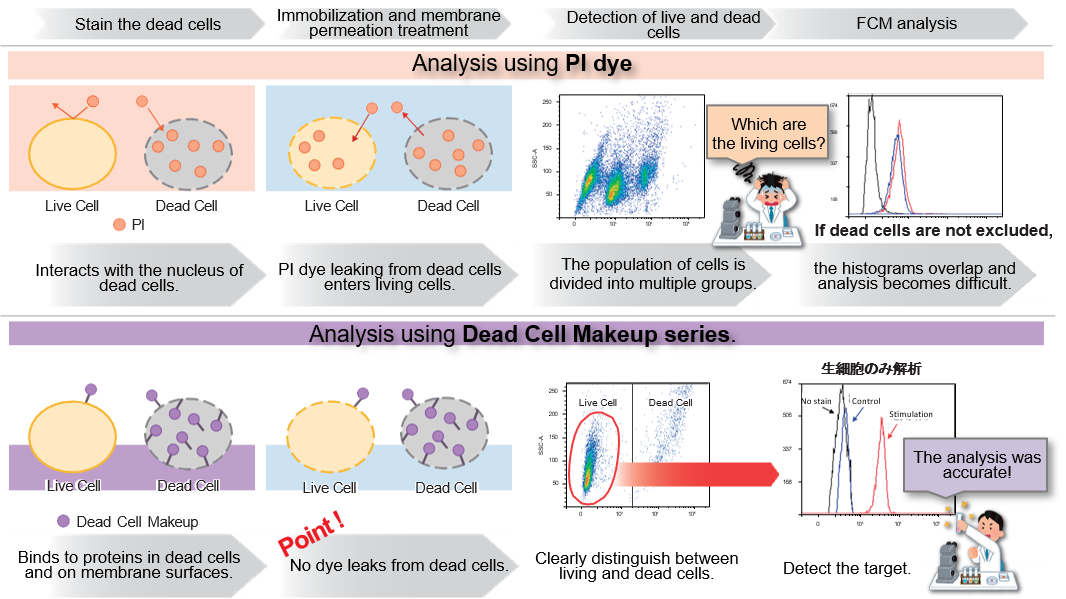
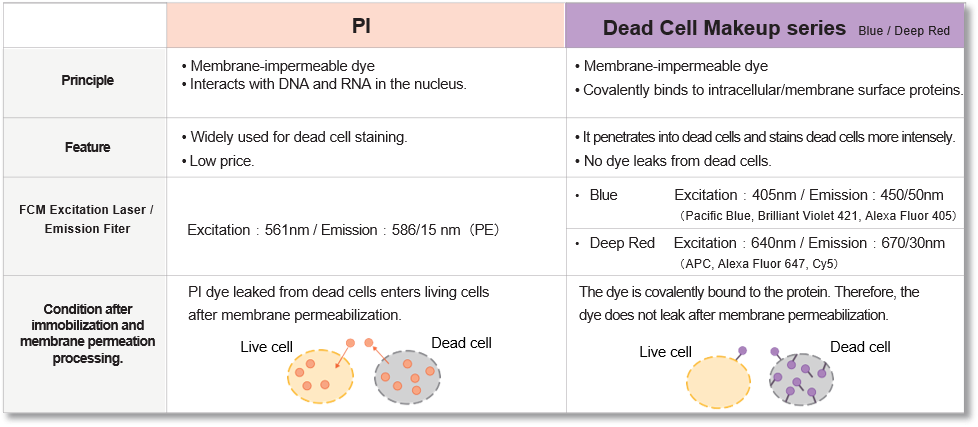
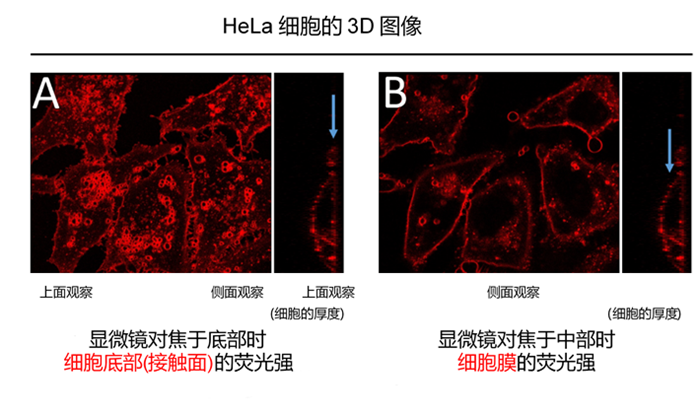
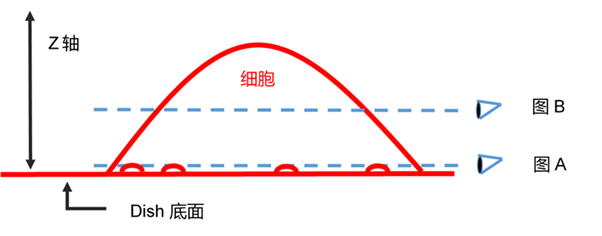
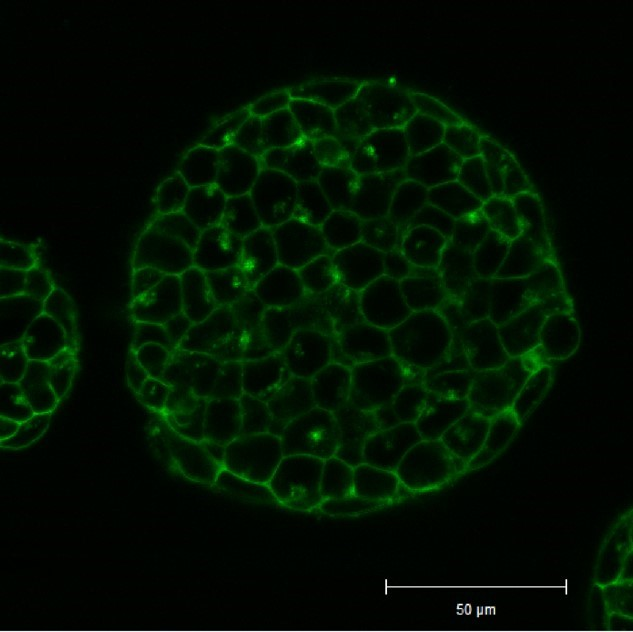
实验例:ES细胞群内部的细胞膜染色
将小鼠ES细胞在涂有明胶的玻璃底皿中培养4天,并将获得的细胞群,用PlasMem Bright Green(200倍稀释)染色15分钟,并使用共聚焦显微镜(Zeiss:LSM710)中观察。
结果,细胞群内部的细胞膜也可以用PlasMem Bright Green可视化观察。
<观察条件>
细胞膜(PlasMem Bright Green【绿】):Ex.488 nm/Em.500-560 nm.
*此实验例由庆应义塾大学医学院的石津 大嗣老师提供。
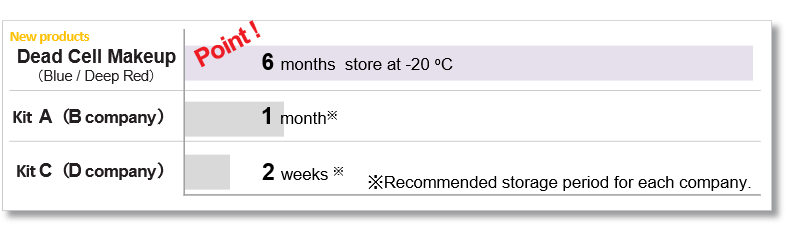
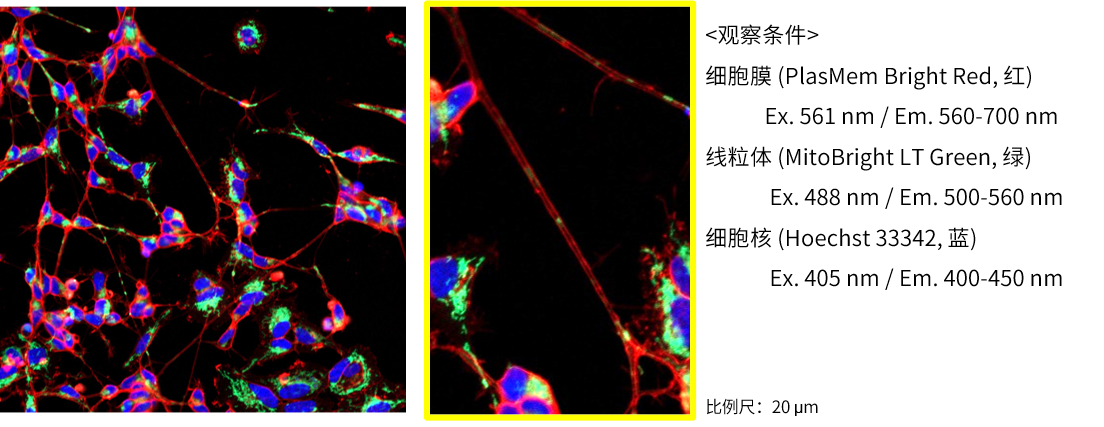
实验例:轴突神经细胞形态和线粒体定位的观察
由神经母细胞瘤细胞SH-SY5Y分化诱导的神经细胞,分别用PlasMem Bright Green (绿)、MitoBright LT Red (红)、Hoechst 33342 (蓝) 进行染色。可以鲜明的观察到细胞的形状以及轴突内的线粒体。

(比例尺:200 μm)
<观察条件>
细胞膜(PlasMem Bright Green【绿】):Ex.488 nm/Em.500-560 nm。
线粒体(MitoBright LT Red【红】):Ex.561 nm/Em.560-620 nm。
细胞核(Hoechst33342【蓝】):Ex.405 nm/Em.400-450 nm。
<实验步骤>
(1)诱导神经芽细胞(SH-SY5Y)为神经细胞。
(2)去除上清液,添加使用培养基中稀释200倍的PlasMem Bright Green、Hoechst 33342(终浓度:5μg/ml)以及MitoBright LT Red(终浓度0.1 μmol/l)。
(3)培养30分钟。
(4)去除上清液,添加HBSS。
(5)使用荧光显微镜观察。
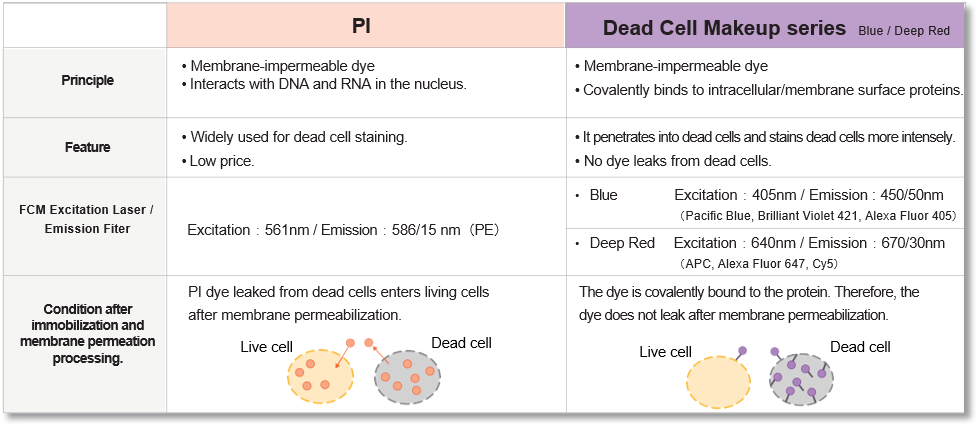
实验例:神经芽细胞(SH-SY5Y)中的线粒体检测
分别用PlasMem Bright Green (绿)、MitoBright LT Red (红)、Hoechst 33342 (蓝) 对神经母细胞瘤细胞SH-SY5Y进行染色,用共聚焦显微镜获得3D图像。可以鲜明的观察到细胞形态以及线粒体和细胞核的情况。
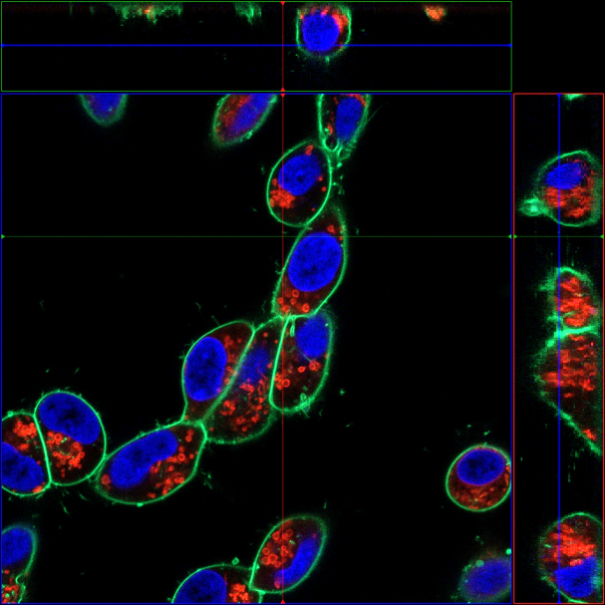
(比例尺:10 μm)
<观察条件>
细胞膜(PlasMem Bright Green【绿】):Ex.488 nm/Em.500-560 nm。
线粒体(MitoBright LT Red【红】):Ex.561 nm/Em.560-620 nm。
细胞核(Hoechst33342【蓝】):Ex.405 nm/Em.400-450 nm。
<实验步骤>
(1)使用HBSS清洗SH-SY5Y细胞。
(2)添加使用培养基中稀释200倍的PlasMem Bright Green、Hoechst 33342(终浓度:5μg/ml)以及MitoBright LT Red(终浓度0.1 μmol/l)。
(3)培养10分钟。
(4)使用HBSS清洗细胞2次
(5)使用荧光显微镜观察。
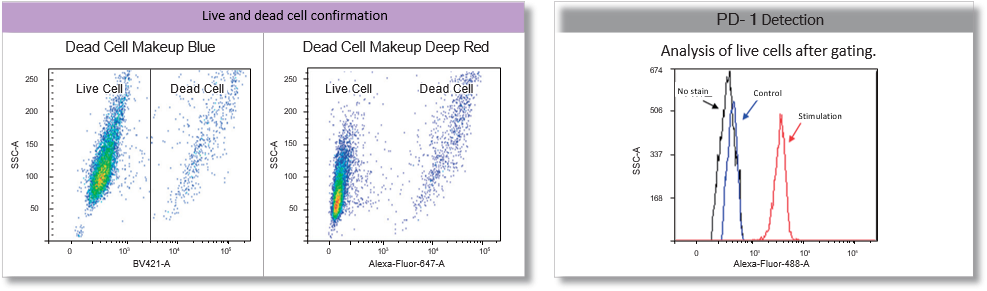
实验例:脑源性小鼠神经母细胞瘤的延时成像
使用培养基中稀释200倍的PlasMem Bright Green,染色N1E-115细胞30分钟并进行延时成像时,可以清楚地观察到神经细胞内树突和突起中的变化。
<培养条件>
・细胞:N1E-115细胞(脑源性小鼠神经母细胞瘤)
・培养基:5%FBS,1%含谷氨酰胺的D-MEM(低葡萄糖)
・培养设备:35 mm 玻璃底皿
<拍摄条件>
・成像设备:带培养箱的荧光显微镜
・拍摄时间:1小时,拍摄间隔:2分钟
*此实验例由芝浦理工大学系统科学与工程学院的涌澤 充 様、福井 浩二教授提供。
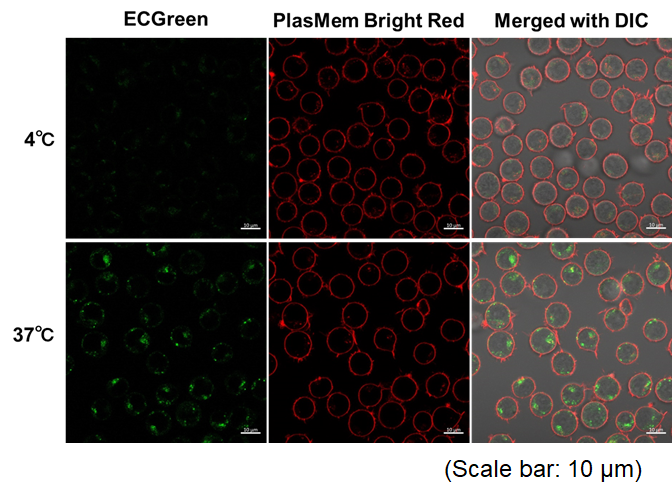
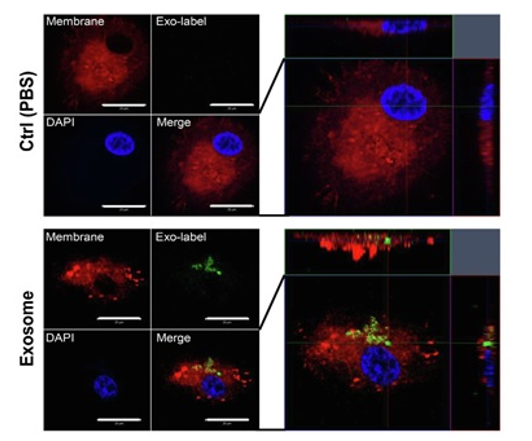
实验例:与外泌体共染色
向PlasMem Bright Green染色的HeLa细胞中加入外泌体膜荧光染色试剂盒(ExoSparkler Exosome Membrane Labeling Kit-Red)染色的外泌体。可以观察到,由活细胞的细胞膜产生的内体(Endosome)中的外泌体,以及没有摄入外泌体的内体。另外,即使在固定染色的细胞之后,也可以像活细胞一样使存在于细胞膜来源的囊泡(内体)中的外泌体可视化。


(比例尺:5 μm)

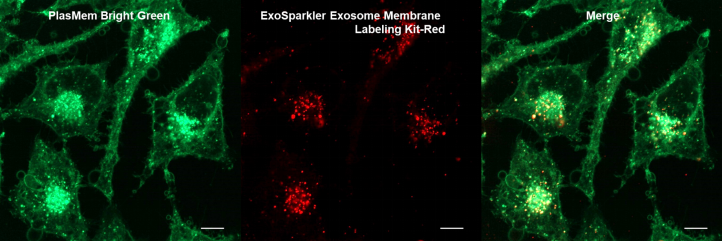
(比例尺:10 μm)
<观察条件>
细胞膜 (PlasMem Bright Green, 绿) Ex. 488 nm / Em. 500-560 nm。
外泌体 (ExoSparkler Exosome Membrane Labeling Kit-Red, 红) Ex. 561 nm / Em. 560-620 nm。
<实验步骤>
(1)接种Hela细胞,24小时培养。
(2)去除上清液,添加使用培养基稀释的PlasMem Bright Green(100倍稀释)。
(3)培养10分钟。
(4)使用HBSS清洗细胞3次。
(5)添加175 μlMEM培养基与ExoSparkler Exosome Membrane Labeling Kit-Red染色过的Exosome溶液25 μl。
(6)在CO2培养箱中过夜培养。
(固定情况下)细胞使用HBSS清洗2次后添加4%PFA,培养15分钟后,使用HBSS清洗细胞2次。
(7)使用共聚焦显微镜观察
实验例:烟草BY2细胞的膜染色
用PlasMemBright Green (200倍稀释)染色烟草BY2细胞5分钟,清洗后每5分钟拍摄一次并进行长时间观察。实验中可以清晰的观察到BY2细胞膜的荧光以及细胞分裂所形成的细胞板。
(数据由名古屋大学栗原大辅老师友情提供)
<检测条件>
・转盘式共聚焦显微镜观察
・Ex: 488 nm; Em: 520/35 (502.5-537.5 nm)
・图中的时间按照00:00 (小时:分钟)表示
实验例:拟南芥根的染色
用PlasMemBright Green (200倍稀释)染色拟南芥根15分钟,采用Z轴景深连续拍照的方法进行荧光观察,可以清晰的观察到立体的细胞膜分布情况。
(数据由名古屋大学栗原大辅老师友情提供)
<检测条件>
・转盘式共聚焦显微镜观察,Z轴摄影
・Ex: 488 nm; Em: 520/35 (502.5-537.5 nm)