上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 Extracellular OCR Plate Assay Kit
Extracellular OCR Plate Assay Kit
Extracellular OCR Plate Assay Kit
- 細胞増殖/細胞毒性測定用試薬
- ミトコンドリア関連
- 細胞内代謝
酸素消費速度プレートアッセイキット
- 細胞のOCRを汎用の蛍光プレートリーダーで測定できる
- 専用の装置や培地、プレートは不要
- 必要な試薬とOCR自動算出シートを準備
-
製品コードE297 Extracellular OCR Plate Assay Kit
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 100 tests | ¥48,000 | 347-10051 |
【注意点】
・本測定には温調機能付きのプレートリーダーが必要です。
| 100 tests | ・Oxygen Probe ・Mineral Oil |
110 ×l×1 10 ml×1 |
|---|
- ご購入方法
- お問い合わせ
マニュアル
-
取扱説明書 日本語

-
Manual English

-
OCR計算シート Ver.2

ミネラルオイルの入れ方
技術情報
キットの原理
Extracellular OCR Plate Assay Kitには、培地中の酸素濃度が低下するとりん光強度が高くなる特性を持つOxygen Probeと、空気中の酸素流入を遮断するためのMineral Oilを同梱しています。細胞外の酸素濃度に応じたりん光強度を蛍光マイクロプレートリーダーで測定後、Stern-Volmerの関係式より細胞のOCRを算出(自動計算シート)します。
本製品は、群馬大学 吉原 利忠 先生のご指導の下、製品化しました。

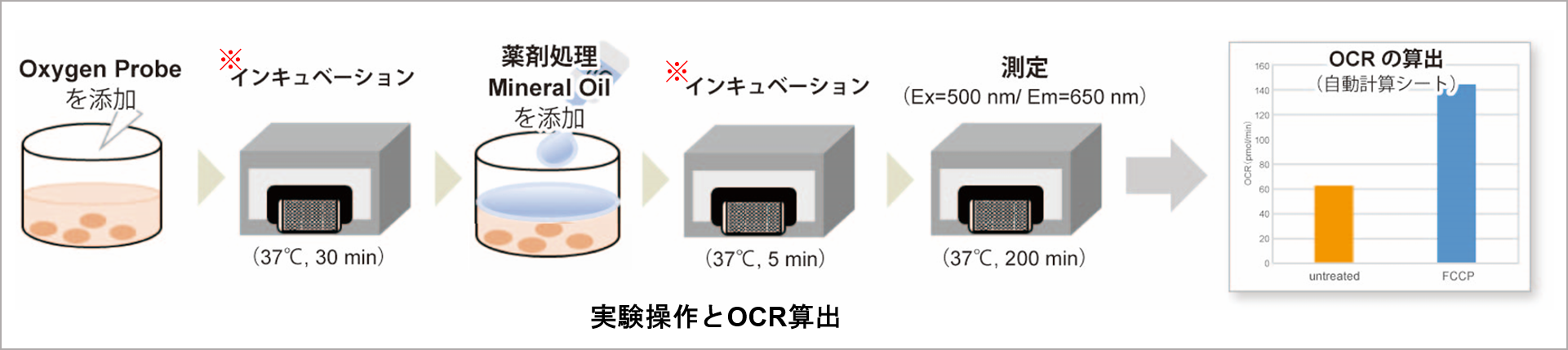
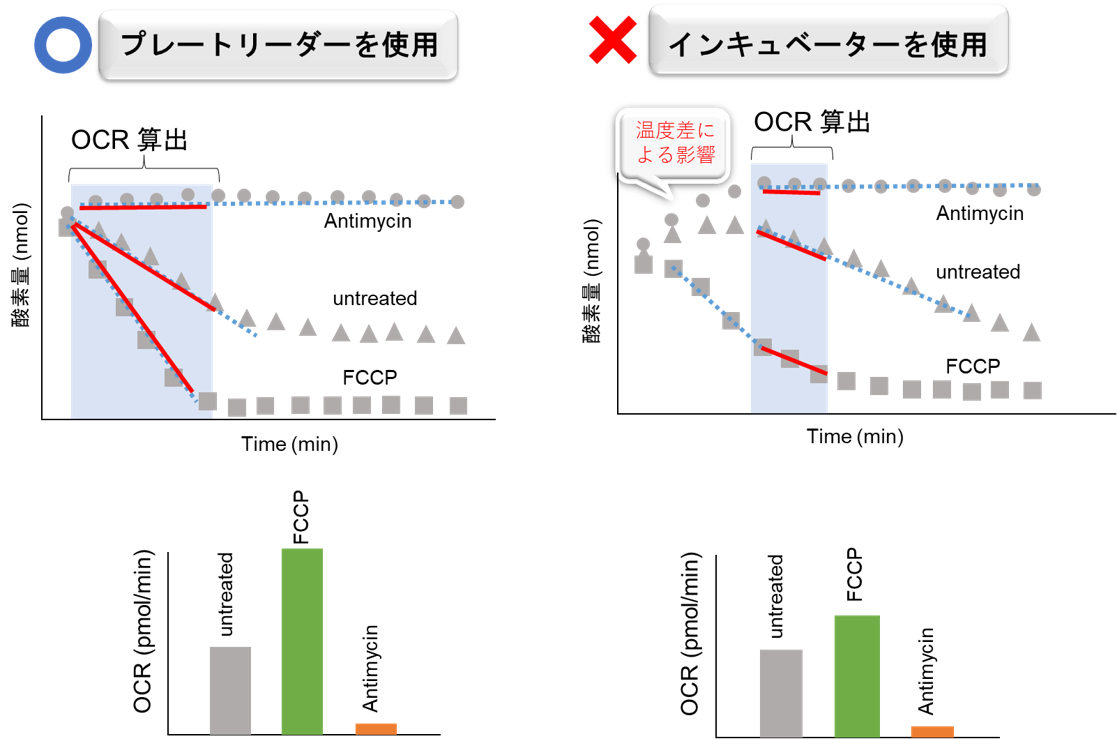
※ウェル内の温度を一定にするために必ずプレートリーダー内で行ってください。
よくある質問 なぜプレートリーダー内でマイクロプレートを恒温にするのですか? をご参照ください。
実験例:細胞種における代謝経路依存性の比較
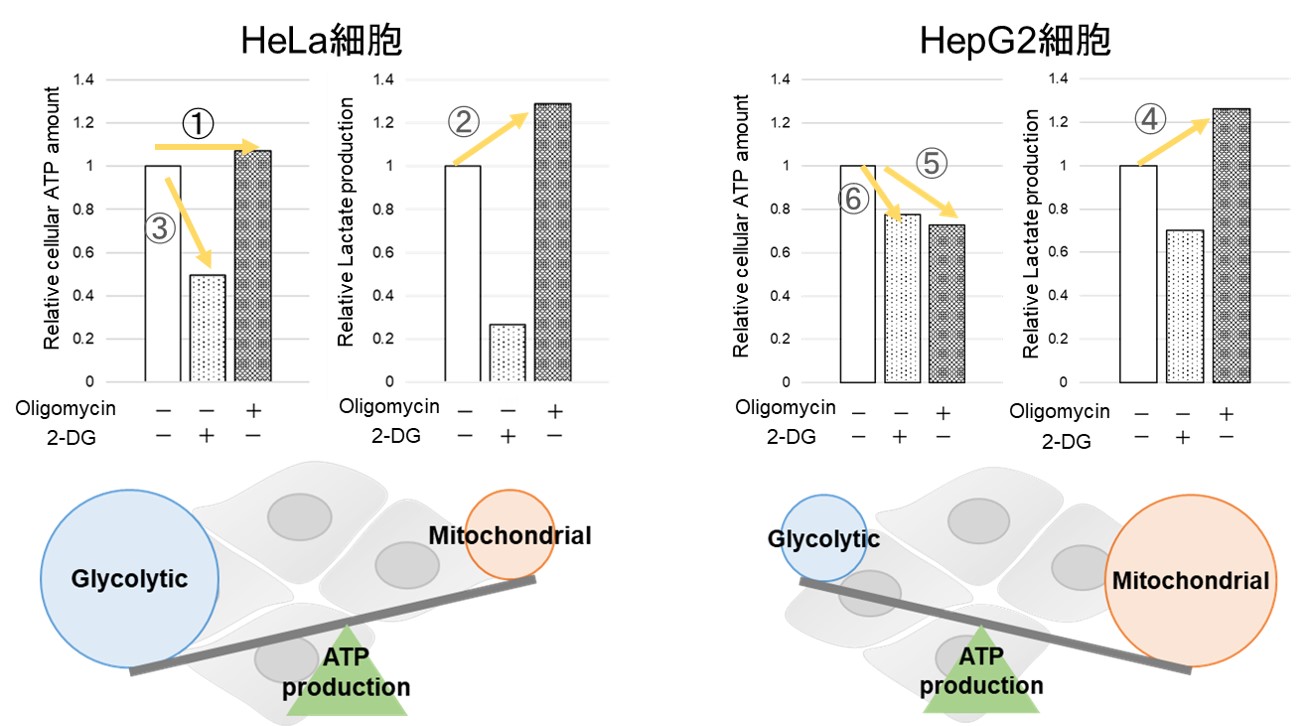
多くのがん細胞は解糖系に依存したエネルギー代謝により ATP を産生しています。一方で、解糖系が抑制されたがん細胞はミトコンドリア機能を亢進させることでエネルギー代謝を酸化的リン酸化にシフトさせ生存していることが近年報告されており、細胞種によって代謝経路の依存性が異なります。
2種類のがん細胞(HeLa細胞とHepG2細胞)における酸化的リン酸化と解糖系へのエネルギー産生の依存度合をLactate生成量とATP量およびOCR値より比較しました。
<Lactate生成量とATP量による評価>
Oligomycin刺激により酸化的リン酸化でのATP合成を阻害、また2-Deoxy-D-glucose(2-DG)により解糖系でのATP合成を阻害した際のATP量とLactate生成量の変化を確認したところ、
HeLa細胞は解糖系に依存し、HepG2細胞は酸化的リン酸化に依存してATP合成している結果が得られました。
*結果の補足説明は右側部分”技術や使用製品に関する補足”をご参照ください。
使用製品:Glycolysis/OXPHOS Assay Kit (製品コード:G270)
<OCR値による評価>
同じ細胞数にてミトコンドリア脱共役剤であるFCCP刺激により、細胞の酸素消費を促進した際のOCRを測定しました。
結果、HepG2細胞はHeLa細胞よりもOCR値が高く酸化的リン酸化への依存度が大きいことが示唆され、ATP量やLactate量を指標に評価した場合と相関する結果が得られました。
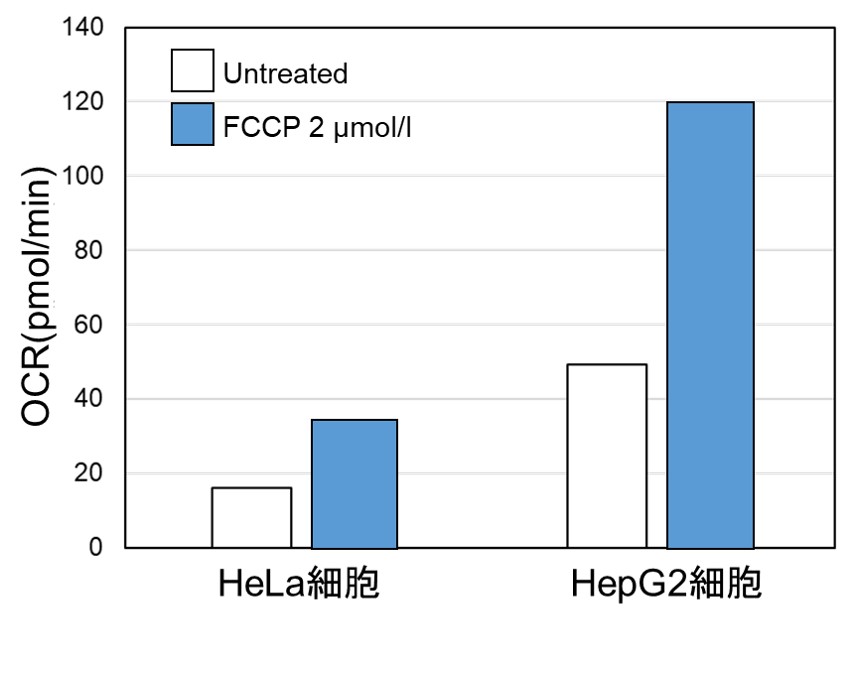
〈実験条件〉
細胞 :HeLa, HepG2
細胞数 :5×104 cells/well
薬剤 :FCCP
薬剤濃度:2 μmol/l
使用製品:Extracellular OCR Plate Assay Kit (製品コード:E297)
技術や使用製品に関する補足
<Lactate生成量とATP量による評価>
HeLa細胞は酸化的リン酸化を阻害した際、ATP量は変わらず(①)、Lactate生成量が増加する(②)ことから、酸化的リン酸化が阻害されても解糖系をさらに活性化することができ、逆に解糖系を阻害するとATP量が大きく減少することから(③)、エネルギー産生を解糖系に依存していることが示唆されました。一方、HepG2細胞は、酸化的リン酸化を阻害した際、Lactate生成量が増加していることから(④)、解糖系の亢進によりエネルギー産生を補おうとしているがATP量は減少している(⑤)、すなわち解糖系を亢進させてもATP産生を補えていないこと、さらに解糖系を阻害した場合よりもATP量が減少する(⑥)ことから、エネルギー産生を解糖系よりも酸化的リン酸化に依存しているということが示唆されました。
参考文献
| 文献No. | 対象サンプル | 引用(リンク) |
|---|---|---|
| 1 | 細胞 (HepG2) | K. Saito, et al, "Obesity-induced metabolic imbalance allosterically modulates CtBP2 to inhibit PPAR-alpha transcriptional activity", J. Biol. Chem., 2023, doi:10.1016/j.jbc.2023.104890. |
| 2 | 細胞 (NIH3T3-L1) | S. Oki, S. Kageyama, Y. Morioka and T. Namba, "Malonate induces the browning of white adipose tissue in high-fat diet induced obesity model", Biochem Biophys Res Commun., 2023, doi:10.1016/j.bbrc.2023.08.054. |
| 3 | 細胞 (Primary Hepatocyte) | S. Tsuno, K. Harada, M. Horikoshi, M. Mita, T. Kitaguchi, M. Y. Hirai, M. Matsumoto and T. Tsubo , 'Mitochondrial ATP concentration decreases immediately after glucose administration to glucose-deprived hepatocytes', FEBS Open Bio, 2023, doi:10.1002/2211-5463.13744. |
| 4 | 精子 | P. S. Sushadi, M. Kuwabara, E. E. W. Maung, M. S. M. Mohtar, K. Sakamoto, V. Selvaraj and A. Asano, "Arresting calcium-regulated sperm metabolic dynamics enables prolonged fertility in poultry liquid semen storage", Sci. Rep., 2023, doi:10.1038/s41598-023-48550-2. |
よくある質問
-
Q
1キットあたりの測定可能なサンプル数の目安を教えてください。
-
A
1つの細胞種で同一細胞数にて実験する場合24サンプル測定可能です。
*2種類以上の細胞種や複数の細胞数を実験に用いる場合は、別途BlankとControlを準備する必要があり測定可能なサンプル数が変わります。詳細については、取扱説明書に実験系に応じたプレートレイアウトの例を記載しておりますのでご参照ください。
-
Q
浮遊細胞の実験例を教えてください。
-
A
Jurkat細胞の実験例をご案内します。
<操作>
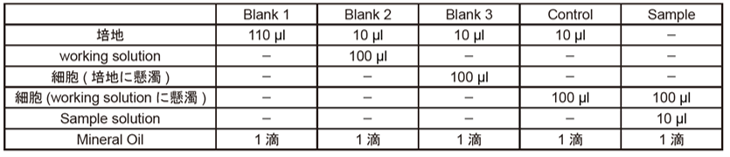
(1)Blank 3としてJurkat細胞(3.0×106 cells/ml)をRPMI培地に懸濁し、ControlやSampleとしてJurkat細胞(3.0×106 cells/ml)をworking solutionに懸濁したものを用意し、96穴黒色クリアボトムマイクロプレートに100 µl (300,000 cells/well)ずつ播種した。
(2)Blank 1にはRPMI培地を100 µl、Blank 2にはworking solutionを100 µl添加した。
(3)予め37℃に設定しておいたプレートリーダーの中にマイクロプレートを入れ、30分間インキュベーションした。
(4)Blank 1, Blank 2, Blank 3, ControlにRPMI培地を10 µlずつ添加した。
(5)Sampleには、RPMI培地で希釈したSample solution(AntimycinもしくはFCCP溶液)を10 µlずつ添加した。
(6)Sample solution添加後は、直ちにMineral Oilを1滴ずつ各ウェルに滴下した。
(7)37℃に設定しておいたプレートリーダーの中にマイクロプレートを入れ、5分間インキュベーションした。
(8)蛍光プレートリーダーを用いて強度をタイムコースで10分毎に200分間測定した(Ex: 500 nm, Em: 650 nm, Bottomリーディング)。
(9)ダウンロードした専用の計算シートに得られた強度の値を入力し、OCR値を算出した。各ウェルに必要なサンプル及び試薬の添加量
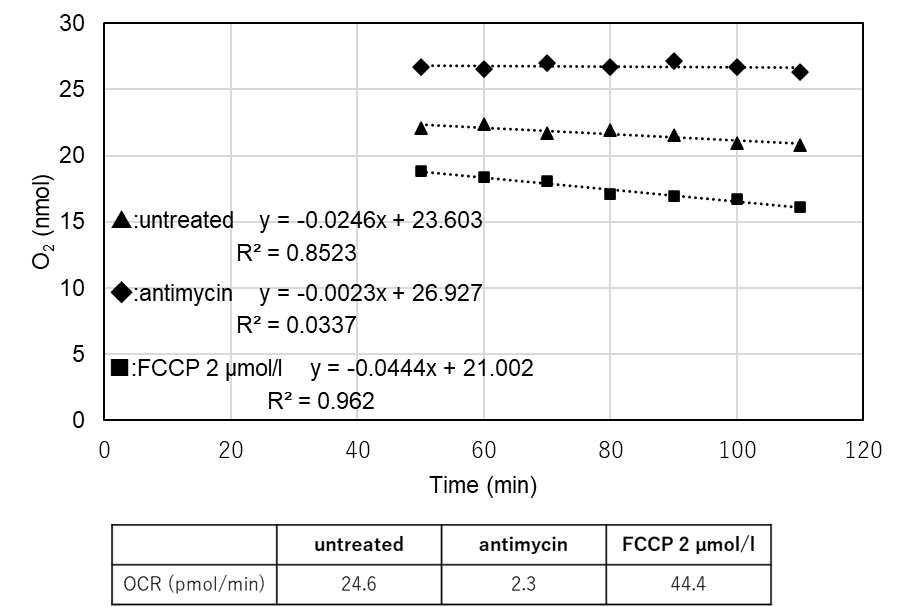
<結果>
-
Q
本キットのOCR算出方法を教えてください。
-
A
専用の計算シートをダウンロードし、以下の手順でOCRを算出します。

<OCR算出手順の概要>
(1)OCR測定で得られた強度の値を計算シートに入力すると、Stern-Volmerの式より酸素量(nmol)が自動的に算出される。
(2)時間(min)と酸素量(nmol)のグラフより、測定した全ての条件において直線性の得られる範囲を確認する。
(3)2)で確認した時間(min)と酸素量(nmol)の範囲における傾きを算出する。
(4)3)で算出した傾きより、OCR(pmol/min)を算出する。
詳細は取扱説明書の"解析"をご参照ください。
-
Q
なぜプレートリーダー内でマイクロプレートを恒温にするのですか?
-
A
試薬の添加およびMineral Oil添加後のマイクロプレートのインキュベーションを、インキュベーター(ヒートブロックや恒温槽など)で行うとプレートリーダー内との温度差が生じ正確なOCR変化が測定できません。再現性の低下に繋がります。そのため必ずプレートリーダー内で行って下さい。
<操作概要>
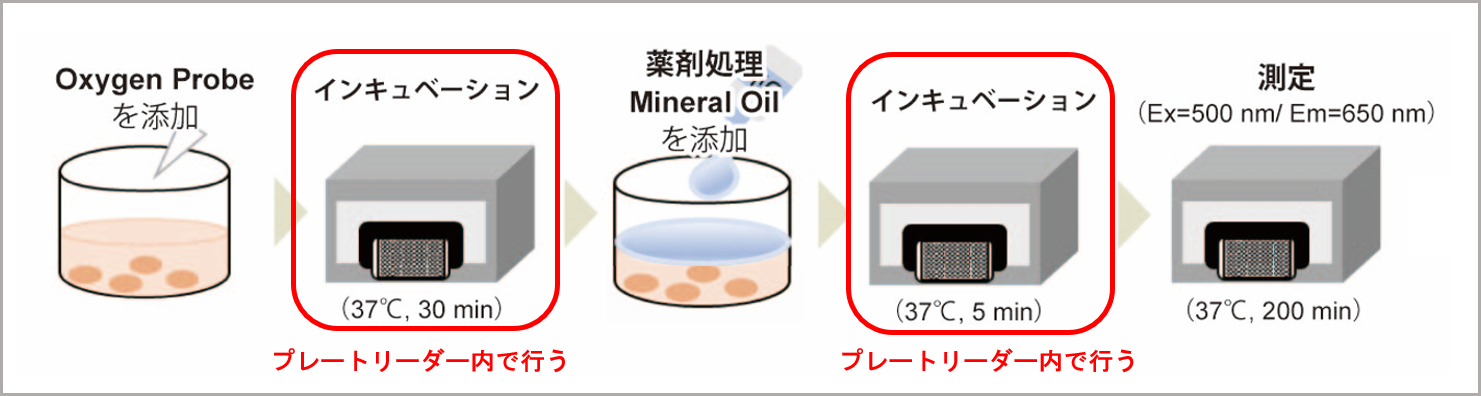
取扱説明書の浮遊細胞:操作3),7)、付着細胞:操作5),9)にあたります。<インキュベートの環境による結果への影響>
-
Q
Mineral Oilに細胞毒性はありませんか。
-
A
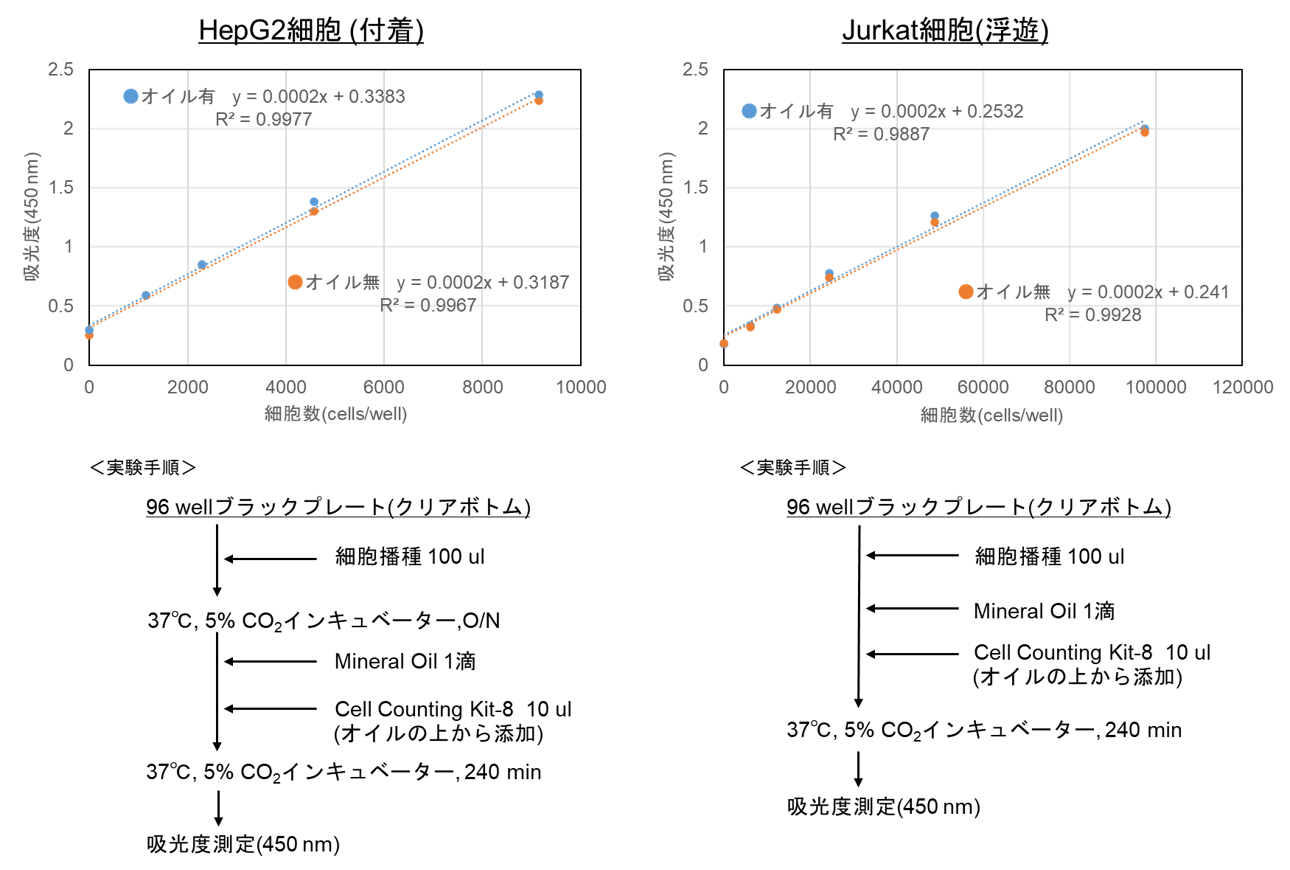
Mineral oilを添加した細胞においてCell Counting Kit-8による細胞毒性測定を行ったところ、毒性は確認されませんでした。
(参考)
-
Q
OCR測定後の細胞数を計測する方法を教えてください。
-
A
核染色剤(Hoechst 33342)を用い、ウェルあたりの細胞数を算出した実験例をお示しします。
<操作>
(1)OCR測定用ウェルに細胞を播種した。
(2)段階希釈した細胞を検量線作成用ウェルに播種した。
(3)取扱説明書に従いOCRを測定した。
(4)検量線作成用ウェルに培地を10 µl/wellずつ添加した(液量をOCR測定用ウェルと110 µl/wellに揃えるため)。
(5)培地で希釈したHoechst 33342溶液(10 µg/ml)を全てのウェルに100 µl/wellずつ添加した。
※OCR測定用ウェルはオイル上から添加した。
(6)37℃、30分間インキュベートした。
(7)蛍光プレートリーダーにて測定した(Ex: 350 nm , Em: 461 nm )。
(8)検量線(X軸:細胞数、Y軸:蛍光強度)を作成し、OCR測定用ウェルの細胞数を算出した。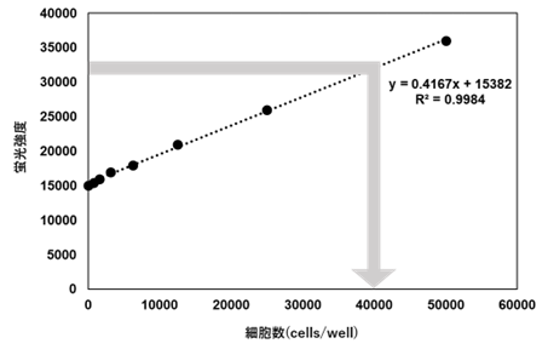
-
Q
Working solutionは保存できますか。
-
A
working solutionは保存できません。用時調製してください。
-
Q
Oxygen ProbeやMineral Oilは凍結融解を繰り返しても測定に影響しませんか。
-
A
Oxygen ProbeおよびMineral Oilは凍結融解を繰り返した場合も測定に影響がないことを確認しています。
-
Q
Topリーディングでも測定できますか?
-
A
Topリーディングでの測定は、オイルの影響を受けるためお奨めしません。Bottomリーディングでの測定を推奨しております。
-
Q
測定時にシェイキングを行う必要はありますか?
-
A
シェイキングする必要はありません。お客様の事例となりますが、シェイキングすることで値がバラつき易くなる傾向がみられております。
-
Q
血清不含培地でも測定できますか?
-
A
測定自体は可能です。ただし、血清含有よりも蛍光値としては低く出る傾向が得られています。結果を比較する場合は毎回同じ培地条件で測定してください。
-
Q
37℃以外の温度でも測定できますか?
-
A
本キットは37℃、110 μl液量中の酸素濃度から酸素消費速度を求める仕様に最適化しております。37℃以外の温度では測定自体は可能ですがキットとしてのOCRは算出出来ません。
-
Q
【トラブル】コントロールと薬剤処理サンプルのOCR値に差がありません。どのような要因が考えられますか?
-
A
以下の3点をご確認ください。
(1) 測定時の温度がバラつくと正確なOCR変化が測定できません。
以下の操作をご確認ください。
・Mineral Oilや培地、培地で希釈したSample solutionは使用前に37℃付近になるように予め加温してください。
・試薬の添加後及びMineral oil 添加後のインキュベーションは、必ず37℃の蛍光プレートリーダー内で行ってください。
よくある質問「なぜプレートリーダー内でマクロプレートを恒温にするのですか」をご参照ください。(2)細胞数が少ない可能性があります。
細胞数を増やしてご検討ください。【細胞数と薬剤処理有無でのOCR変化(イメージ図)】
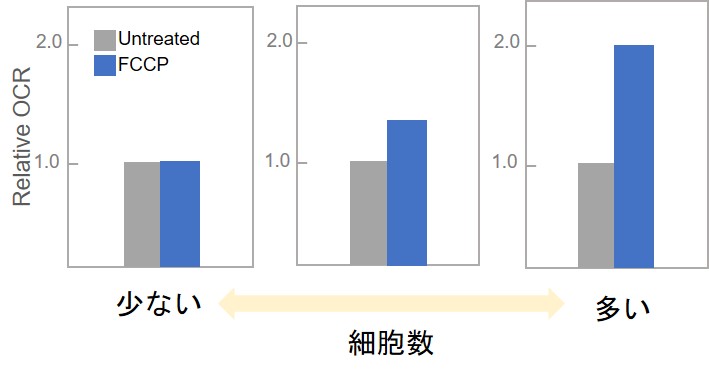
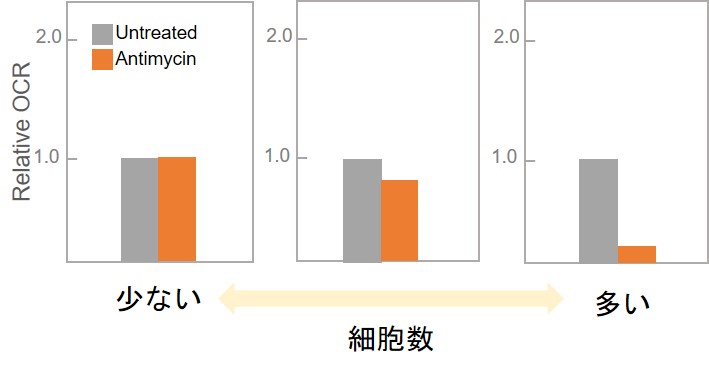
(3)細胞の影響
1),2)を確認してもなおOCR値に差が得られない(小さい)場合、以下のような可能性がございます。・細胞自体の呼吸量が少ない。正常細胞はがん細胞と比較しOCRが低くなる傾向があります。
・細胞のエネルギー産生を解糖系へ大きく依存している。(参考)
2種類のがん細胞(HeLa細胞とHepG2細胞)のOCRを比較した際、エネルギー産生を解糖系へ大きく依存しているHeLa細胞はHepG2細胞と比較しOCR値が低い結果が得られました。
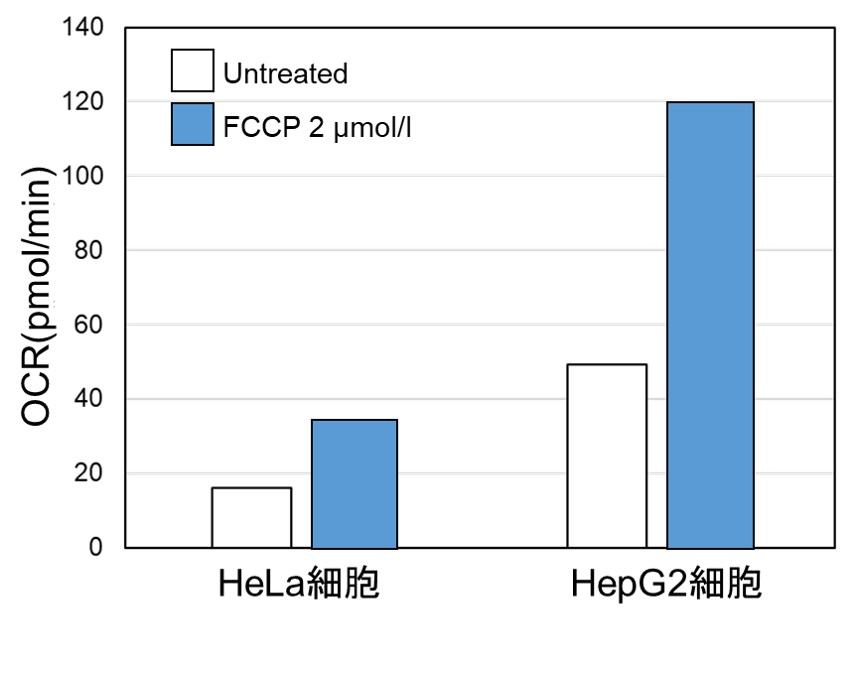
※細胞種における代謝経路依存性の確認方法については、こちらをご覧ください。
-
Q
【トラブル】「蛍光強度が経時的に低下・酸素濃度が上昇・OCR値がマイナス」を示します。どのような要因が考えられますか?
-
A
以下の5点をご確認ください。
(1) Bottom リーディングで測定していますか?
Top リーディングでの測定は、オイルの影響を受け正しい値が得られないことがあります。Bottomリーディングでの測定を推奨しています。(2) 測定Well内の温度は一定ですか?念のため実測値をご確認ください。
OCR測定は温度に非常に敏感です。Well内の温度がばらつくと初期の測定値がばらつきやすくなりOCR値に影響します。対処法は、よくある質問 なぜプレートリーダー内でマイクロプレートを恒温にするのですか をご参照ください。(3) シェイキングを行っていませんか?
お客様の実績より、シェイキングすることで結果がばらつきやすくなる傾向が得られております。シェイキング無しでもお試しください。(4) 測定毎の照射時間、照射回数の設定値を通常(デフォルトの設定値)よりも高い値に設定していませんか?
1回の照射時間や照射回数が高すぎると、強い励起光を経時的に当て続けることになり、プローブが劣化する可能性があります。設定値を下げてご検討ください。
※プレートリーダーの機種により設定項目が異なります。設定についてはプレートリーダーのメーカー様へお問い合わせください。(5) 酸素消費量がキットでは検出できない非常に小さい量の可能性があります。
細胞数を増やしてご検討ください。また、よくある質問 コントロールと薬剤処理サンプルのOCR値に差がありません。どのような要因が考えられますか? も併せてご参照ください。


取扱条件
| 保存条件: 冷凍,遮光 |

関連製品
この製品に関連する研究では、下記の関連製品も使われています。
-
解糖系/酸化的リン酸化測定キット
Glycolysis/OXPHOS Assay Kit
-
ミトコンドリア膜電位検出キット
JC-1 MitoMP Detection Kit
-

ミトコンドリア スーパーオキサイド検出用蛍光色素
mtSOX Deep Red – Mitochondrial Superoxide Detection
-
MT-1ミトコンドリア膜電位検出キット
MT-1 MitoMP Detection Kit