上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
特点:
● POD标记的产品可以在大约3个小时内制备。
● 可以标记高分子量化合物(MW> 50,000)和低分子量化合物(MW <5,000)。
● 可以标记50至200μg的蛋白质。
● POD标记的产品只需与NH2-反应性过氧化物酶混合即可形成。
● 可以通过使用过滤管的分离操作以高回收率获得标记物质。
● POD标签可以用随附的保存溶液保存。


试剂盒内含

产品概述
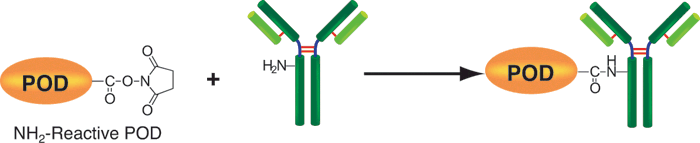
该试剂盒主要用于制备酶免疫分析 (EIA) 所需的辣根过氧化物酶标IgG以及竞争性EIA所需的辣根过氧化物酶标抗原。该试剂盒中的NH2-reactive peroxidase具有琥珀酰亚胺基 (NHS),它能够与含有NH2的蛋白质或者其他分子反应。该试剂盒包含了标记过程中所需的所有试剂,包括储存用缓冲液。标记过程相当简单:只需将IgG和NH2-reactive peroxidase混合并且在37℃下培养2小时。NH2-reactive peroxidase不需任何活化就可以和靶分子形成共价键。NHS与辣根过氧化物酶之间的距离大约为1.2nm,为辣根过氧化物酶分子半径的一半。因此,当辣根过氧化物酶标IgG用于EIA时,NH2-reactive peroxidase的高效性足以使它在标记后省去纯化的过程。即使在标记后需要有一个高纯度的精制过程,也只要用亲和柱或凝胶渗透柱就能简单达到目的。在标记小分子的时候,使用试剂盒中包含的过滤管即可除去分子量较大的分子。由于NH2-reactive peroxidase自身的氨基已经被阻断,因此自身不会发生反应。
原理
操作步骤
使用注意事项:
1.所需标记的较大的蛋白质的分子量要>50,000。
2.所需标记的较小的氨基化合物的分子量要<5,000。
3.标记过程中,标记前后的IgG总是在过滤管的滤膜上。
4.如果IgG溶液含有其它分子量超过10,000的蛋白质,如BSA或凝胶,在使用该试剂盒标记前请先纯化IgG溶液。IgG溶液能够使用IgG纯化试剂盒来纯化(不包含于此试剂盒中)。如果IgG溶液中含有小的不溶物,离心后提取上清液来标记。
5.如果长时间不使用,建议您把试剂盒中的酶NH2-reactive peroxidase放在-20℃冰箱中保存,不需要充氮气,可以更好地保持酶的活性,但请不要把其它试剂和过滤管放到-20℃冰箱中,仍请放在0-5℃冰箱中保存。
标记IgG操作步骤:
(1)将100μl Washing buffer以及含有50-200μg IgG的样品溶液加入到过滤管中。a)
(2)8,000-10,000g离心10分钟后,加入100μl Washing buffer再离心一次。b)
(3)将10μl Reaction buffer加入到NH2-reactive peroxidase中并用移液器吹打使其溶解。
(4)将含有NH2-reactive peroxidase的溶液转移到IgG所集中的过滤管的滤膜上。
(5)用移液器吸取溶液吹吸净整个滤膜表面,然后将过滤管放入培养箱中,37℃培养2小时。
(6)将100μl Washing buffer加入到过滤管中。如果滤液的体积超过300μl,在进行步骤7前需要先丢弃滤液。
(7)8,000-10,000g离心10分钟。b)
(8)加入200μl Storage buffer并用移液器吹打10到15次来回收标记产物。c)将溶液转移至0.5ml的试管中,并储存于0-5℃下。d)
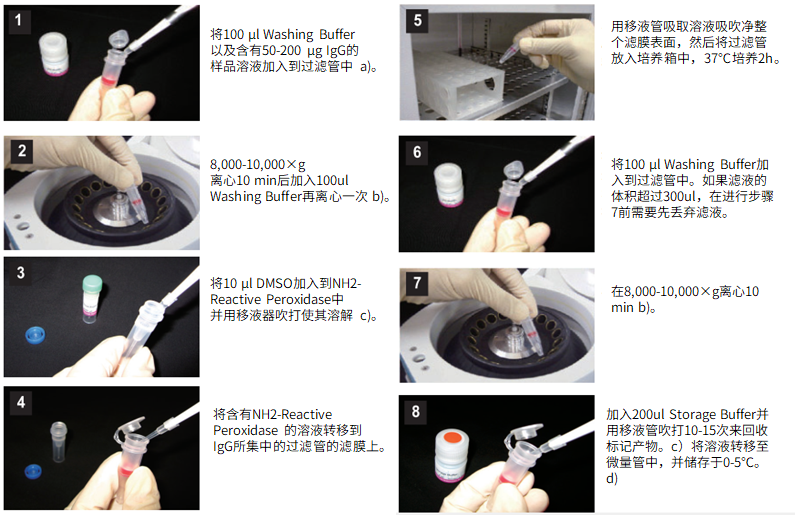
a)推荐的IgG的量为100μg,样品溶液的体积不应超过100μl。如果抗体浓度低于0.5mg/ml,重复步骤1和2直至总的IgG聚积量达到50-200μg。如果在聚积过程中,滤液体积达到或超过了400μl,则需在进行下一步离心前将滤液除去。
b)如果溶液在离心后仍然残留在膜上,可以再离心5分钟或者适当增加转速。
c)标记产物的浓度为0.5-1.3mg/ml。在进行后续的酶免疫,免疫印迹,免疫转染试验前先要将标记后的IgG稀释至适当的浓度。每个IgG分子上会被标记上1-3个辣根过氧化物酶分子。没有被结合的辣根过氧化物酶不会干扰正常的免疫试验。如果一定要纯化的话,可以使用凝胶渗透柱或亲合柱。
d)通常,辣根过氧化物酶标记后的IgG在Storage buffer中,0-5℃下至少能够保存2个月,如果需要保存更久,可以添加等量的丙三醇(终浓度:50%),并在-20℃下存放。但是,还要注意样品自身是否稳定。
标记小分子操作步骤:
(1)用Reaction buffer制备50μl,1mM的氨基化合物,a)并将该溶液加入到NH2-reactive peroxidase管中。吹打数次使其充分混合,然后置于37℃下培养1小时。
(2)将100μl Washing buffer加入到反应液中并将整个溶液全部移入过滤管中。
(3)在8,000-10,000g 离心10分钟,b)弃滤液,向管中加入200μl Washing buffer。再重复该过程一次,然后再在8,000-10,000g 离心10分钟。b)
(4)加入200μl Storage buffer并用移液器吹打10到15次来回收抗体。c)将溶液转移至0.5ml的试管中,并储存于0-5℃下。d)
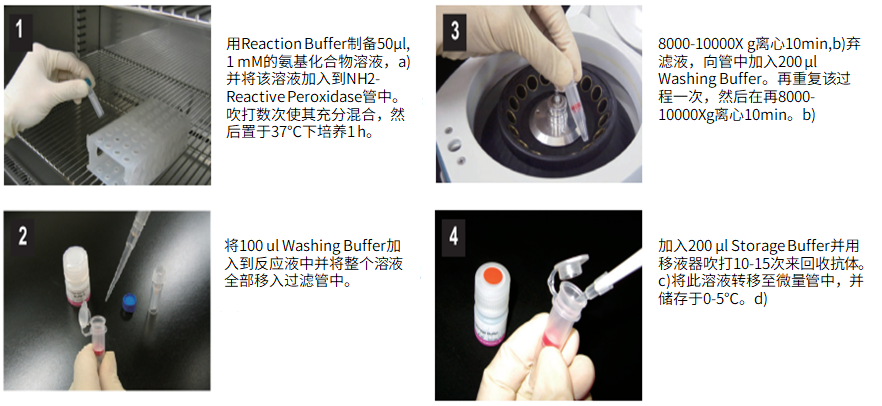
a)如果氨基化合物在水溶液中无法溶解,可以用DMSO使其溶解,制备成10mM的溶液,取5μl 与45μl Reaction buffer混合。
b)如果溶液在离心后仍然残留在膜上,可以再离心5分钟或者适当增加转速。
c)标记产物的浓度大约为400-500μg/ml (10-12.5μM)。1-2个靶分子能够和1个辣根过氧化物酶分子结合。
d)标记后的小分子在0-5℃下能够存放至少6个月。
产品优势
1)POD标记的产品可以在大约3个小时内制备。
2)可以标记高分子量化合物(MW> 50,000)和低分子量化合物(MW <5,000)。
3)可以标记50至200μg的蛋白质。
4)POD标记的产品只需与NH2-反应性过氧化物酶混合即可形成。
5)可以通过使用过滤管的分离操作以高回收率获得标记物质。
6)POD标签可以用随附的保存溶液保存。
常见问题Q&A
| Q1: 标记反应结束后,未反应的NH2-reactive peroxdase是否还具有活性? |
| A:没有了。它在反应过程中会完全被水解。 |
| Q2: 标记反应过程中,NH2-reactive peroxdase是否会形成一些低聚物? |
| A:不会。由于NH2-reactive peroxdase中的所有氨基都被阻断,因此不会有低聚物生成。 |
| Q3: 是否必须要使用试剂盒所包含的Storage Buffer? |
| A:不一定要使用试剂盒所包含的Storage Buffer。可以选择任何适用于该实验的缓冲液。但是,Storage Buffer能够提高标记产物的稳定性。 |
| Q4:Storage Buffer中是否含有动物产品或者高分子聚合物? |
| A:Storage Buffer中不含有任何动物产品,高分子聚合物或者重金属离子。 |
| Q5: 能够使用这个试剂盒标记Fab或者Fab’吗? |
| A:可以标记。并且回收率通常都超过80%。 |
| Q6:能够用这个试剂盒标记其它蛋白质吗? |
| A:可以。只要标记分子的分子量>50,000或者<5,000且具有活性伯胺或仲胺结构。如果分子量>50,000,参照IgG的标记操作说明,使用0.5-1 nmol蛋白样品用LK11-10来标记。 如果分子量<5,000,参照标记小分子的操作说明。如果分子量>5,000且<50,000,请咨询我们的客户服务。Email:info@dojindo.cn 免费电话:800-988-0083 |
| Q7:能够使用这个试剂盒标记寡核苷酸或者寡肽吗? |
| A:可以。只要它的分子量小于5,000且具有活性伯胺或仲胺。可以参照标记小分子的操作说明。 |
| Q8:LK11所能标记的最小的IgG的量是多少? |
| A:最小量为50 μg。标记50 μg与200 μg之间的IgG,在灵敏度和本底上没有太大的区别。尽管这个试剂盒也能标记10 μg的IgG,但是本底会较高。 |
| Q9:每个IgG能够标记多少辣根过氧化物酶分子? |
| A:每个IgG平均能标记上1-3个辣根过氧化物酶分子。 |
参考文献
1) 広田次郎, 清水眞也, “キットを用いたモノクローナル抗体への迅速・簡便なペルオキシダーゼ標識法”, 動物衛生研究所研究報告, 2005, 111, 37.
2) A. Miyagawa-Yamaguchi, N. Kotani, and K. Honke, “Expressed Glycosylphosphatidylinositol-Anchored Horseradish Peroxidase Identifies Co-Clustering Molecules in Individual Lipid Raft Domains”, PLoS ONE., 2014, 9, (3), e93054.
3) J. Zhang, D. Klufas, K. Manalo, K. Adjepong, J.O. Davidson, G. Wassink, L. Bennet, A.J. Gunn, E.G. Stopa, K. Liu, M. Nishibori, and B.S. Stonestreet, “HMGB1 Translocation After Ischemia in the Ovine Fetal Brain”, J. Neuropathol. Exp. Neurol.., 2016, 75, (6), 527.
4) M. Okumura, T. Ozawa, H. Hamana, Y. Norimatsu, R. Tsuda, E. Kobayashi, K. Shinoda, H. Taki, K. Tobe, J. Imura, E. Sugiyama, H. Kishi, and A. Muraguchi, “Autoantibodies reactive to PEP08 are clinically related with morbidity and severity of interstitial lung disease in connective tissue diseases”, Eur. J. Immunol.., 2018, 48, (10), 1717.
5) R. Sugisawa, G. Komatsu, E. Hiramoto, N. Takeda, K. Yamamura, S. Arai, and T. Miyazaki, “Independent modes of disease repair by AIM protein distinguished in AIM-felinized mice”, Sci. Rep.., 2018, 8, 13157.
6) S. Takatsuka, T. Inukai, S. Kawakubo, T. Umeyama, M. Abe, K. Ueno, Y. Hoshino, Y. Kinjo, Y. Miyazaki, and S. Yamagoe, “Identification of a Novel Variant Form of Aspergillus fumigatus CalC and Generation of Anti-CalC Monoclonal Antibodies”, Med Mycol J., 2019, 60, (1), 11.
7) T. Sasaki, K. Liu,T. Agari, T. Yasuhara, J. Morimoto, M. Okazaki, H. Takeuchi, A. Toyoshima, S. Sasada, A. Shinko, A. Kondo, M. Kameda, I. Miyazaki, M. Asanuma, CV. Borlongan, M. Nishibori, and I. Date, “Anti-high mobility group box 1 antibody exerts neuroprotection in a rat model of Parkinson’s disease”, Exp. Neurol.., 2016, 275, 220.
8) T. Tsumuraya, I. Fujii, M. Inoue, A. Tatami, K. Miyazaki, and M. Hirama, “Production of monoclonal antibodies for sandwich immunoassay detection of ciguatoxin 51-hydroxyCTX3C”, Toxicon., 2006, 48, (3), 287.
9) W. Jin, K. Yamada, M. Ikami, N. Kaji, M. Tokeshi, Y. Atsumi, M. Mizutani, A. Murai, A. Okamoto, T. Namikaw, Y. Baba, and M. Ohta, “Application of IgY to sandwich enzyme-linked immunosorbent assays, lateral flow devices, and immunopillar chips for detecting staphylococcal enterotoxins in milk and dairy products”, J. Microbiol. Methods., 2013, 92, (3), 323.
10) W.W.P.N. Weerakoon, M. Sakase, N. Kawate, M.A. Hannan, N. Kohama, and H. Tamada, “Plasma IGF-I, INSL3, testosterone, inhibin concentrations and scrotal circumferences surrounding puberty in Japanese Black beef bulls with normal and abnormal semen”, Theriogenology., 2018, 114, (1), 54.
11) Y. Watanabe, Y. Kazuki, K. Kazuki, M. Ebiki, M. Nakanishi, K. Nakamura, M. Yoshida Yamakawa,H. Hosokawa, T. Ohbayashi, M. Oshimura, and K. Nakashima, “Use of a Human Artificial Chromosome for Delivering Trophic Factors in a Rodent Model of Amyotrophic Lateral Sclerosis”, Mol Ther Nucleic Acids., 2015, 4, (10), e253.
12) Y.S. Kim, D.H. Jung, I.S. Lee, B.J. Pyun and J.S. Kim, “Osteomeles schwerinae extracts inhibits the binding to receptors of advanced glycation end products and TGF-β1 expression in mesangial cells under diabetic conditions”, Phytomedicine., 2016, 23, (4), 388.
13) S .Kon, M. Honda, K. Ishikawa, M. Maeda and T. Segawa, “Antibodies against nephronectin ameliorate anti-type II collagen-induced arthritis in mice.’, FEBS Open Bio., 2019,10.1002/2211-5463.12758.
