上海金畔生物科技有限公司代理日本同仁化学 DOJINDO代理商全线产品,欢迎访问官网了解更多信息
特点:
● 生物素标记的产品可以在大约2小时内制备。
● 只需将NH2反应性生物素与目标蛋白混合即可形成稳定的共价键。
● 可以标记分子量为50,000或更高的蛋白质。
● 可以标记50-200μg的蛋白质。
● 可以通过使用过滤管的分离操作以高回收率获得标记物质。
● 生物素标记的产品可以与试剂盒中包含的存储溶液一起存储。

活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Cell Counting Kit-8 细胞增殖毒性检测
NO.2. Cytotoxicity LDH Assay Kit-WST 乳酸脱氢酶(LDH)检测
NO.3. Fluorescein Labeling Kit – NH2 荧光素标记试剂盒-氨基
NO.4. Peroxidase Labeling Kit – NH2 过氧化物酶标记试剂盒-氨基
NO.5. Biotin Labeling Kit – NH2 (for 1mg) 生物素标记试剂盒-氨基
试剂盒内含

产品概述
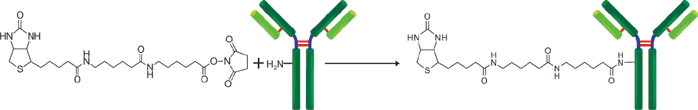
生物素标记试剂盒-NH2是用于用生物素标记带有氨基基团的蛋白质的试剂盒,尤其是抗体,由于该试剂盒中包含的NH2-反应性生物素分子中具有活性酯基,因此仅通过与生物素混合即可形成稳定的共价键。当生物素标记在蛋白质(例如免疫球蛋白G(IgG))上时,可以使用随附的过滤管轻松去除抑制标记反应和未反应的NH2-反应性生物素的低分子量化合物(例如Tris)。因此,没有必要进行诸如透析和凝胶过滤的处理,并且可以以高回收率获得高纯度的标记化合物。
原理
操作步骤
使用注意事项:
1. 用本试剂盒标记的蛋白质的分子量要>50,000。
2. 在标记过程中,IgG或者Biotin-IgG标记物始终存在于过滤管的滤膜上。
3. 如果IgG溶液中含有分子量>10,000的其他蛋白质,如BSA或明胶时,在使用该试剂盒标记前,先要纯化IgG溶液。IgG溶液能够用IgG Purification Kits (不包含于本试剂盒中) 来纯化。
4. 如果IgG溶液含有小的不溶物,离心后取上清液来进行标记。
5. 1管NH2-Reactive Biotin可以标记50-200 ug蛋白质。
标记IgG操作步骤
(1)将100μl WS buffer以及含有100μg IgG的样品溶液加入到过滤管中。a)
(2)8,000-10,000g离心10分钟。b)
(3)将10μl DMSO加入到NH2-reactive biotin中并用移液器吹打使其溶解。c)
(4)将100μl Reaction buffer以及8μl NH2-reactive biotin溶液加入到过滤管中,吹打使其混合。d)
(5)将过滤管放入培养箱中,37℃培养10分钟。
(6)将100μl WS buffer加入到过滤管中,8,000-10,000g离心10分钟,b)除去滤液。
(7)将200μl WS buffer加入到过滤管中,8,000-10,000g离心10分钟,b)重复该步骤一次。
(8)将200μl WS buffer加入到过滤管中吹打10-15次来回收标记产物。e)将该溶液转移到0.5ml试管中,在0-5℃下保存。

a) 样品溶液的体积不应超过100ul。如果蛋白质浓度低于0.5mg/ml,重复操作步骤1和2直至总的蛋白质聚积量达到50-200ug。如果聚积过程中滤液的体积超过400ul,则在进行后续的离心操作前应除去滤液。
b) 如果溶液在离心后仍然残留在膜上,可以再离心5min或者适当增加转速直至膜上没有残留液体。
c) NH2-Reactive Biotin在管子的底部,向管底加入10ul DMSO,吹打数次使其溶解。
d) 如果蛋白质的量为200ug,在操作步骤4时加入所有的NH2-Reactive Biotin-DMSO溶液。
e) 并不一定要使用WS Buffer来回收标记产物,可以选择任何适合于该实验的缓冲液来替代。
产品优势
1)生物素标记的产品可以在大约2小时内制备。
2)只需将NH2反应性生物素与目标蛋白混合即可形成稳定的共价键。
3)可以标记分子量为50,000或更高的蛋白质。
4)可以标记50-200μg的蛋白质。
5)可以通过使用过滤管的分离操作以高回收率获得标记物质。
6)生物素标记的产品可以与试剂盒中包含的存储溶液一起存储。
常见问题Q&A
| Q1:这个试剂盒可以用于标记其他蛋白质吗? |
| A:可以。但是如果含有像血清白蛋白或者明胶的蛋白,标记反应可能会受到干扰。用这个试剂盒标记之前,有必要先纯化抗体溶液。如果您想进一步了解纯化过程可以联系我们。 |
| Q2:我只有少量的IgG,可以标记吗? |
| A:在该试剂盒中,标记所需的IgG量为50至200μg。
在此范围内,性能没有太大差异。 可以用10μg IgG进行标记,但是可能会出现诸如背景升高的问题。 |
| Q3:样品溶液中的共存会影响反应吗? |
| A:它可能会受到共存类型的影响。确认溶液中包含哪种物质后,根据情况纯化用于标记的蛋白质,并将其用于标记反应。
<聚合物:分子量10,000以上>它可能会影响。即使使用Filtration Tube,也无法去除具有氨基的高分子量化合物,例如BSA和明胶。因此,它被标记并充当荧光杂质。 在反应中使用之前,请执行单独的清除操作。另一方面,如果存在许多高分子杂质,即使没有氨基的化合物也可能导致过滤器堵塞。它可能会干扰标记/纯化操作。 *生物素标记试剂盒-不仅需要对NH2采取相同的预防措施,还需要对其他标记试剂盒采取相同的预防措施。 |
| Q4:标记小分子蛋白质(分子量50,000或以下)的方法。 |
| A:由于该试剂盒中包含的过滤管是分子量截断值为30K的超滤过滤器,因此我们建议使用50,000或分子量更大的蛋白质,并留有余量。
当标记分子量为50,000或更小的蛋白质时,可以通过更换为分子量分数较小的超滤过滤器来标记甚至很小的蛋白质,如下所示。 —————————————— PALL Nanocep 3K产品编号OD003C33 PALL Nanocep 10K产品编号OD010C33 —————————————— 离心所需的时间可能比试剂盒中随附的过滤器要长,因此请注意离心时间。 |
| Q5:标记后,离心过滤管,液体仍会留在膜上怎么处理? |
| A:(1)目视检查隔膜时,如果液体稍微残留在隔膜杯的边缘,请继续执行下面操作。如果倾斜和旋转膜杯时液体残留在膜上或滴下,请以8,000 g离心约15至30分钟。
(2)即使在1)中的离心操作之后,如果液体仍留在膜上,请检查标记物质是否聚集。根据抗体或蛋白质本身的特性,用小分子标记剂进行标记可能会增加抗体或蛋白质的疏水性并使其聚集。如果在标记的物质上观察到团聚,将其转移到另一个微管中一次,离心并使用上清液。 (回收的抗体/蛋白质的量将减少。) *如果您怀疑过滤器堵塞,可以通过更换新的膜过滤器来解决。 替代品:PALL Nanocep 30K(制造商代码:OD030C33) |
| Q6:该试剂盒可以标记什么? |
| A:可以标记分子量为“ 50,000或更高”和反应性氨基(NH2)的化合物(抗体,蛋白质等)。标记样品量为“50-200μg”。
*当考虑标记“ mg”的量时,也可以使用“生物素化试剂盒(Sulfo-OSu);同仁产品货号:BK01”。 *由于试剂盒附带的过滤管为30K,因此无法纯化低分子量化合物。 |
| Q7:一个IgG分子能标记多少生物素? |
| A:每个IgG分子平均能标记7至10个生物素。 |
| Q8:标记产物能保存多久? |
| A:在0-5℃下能够保存2个月。如果需要保存更久,可以添加等量的丙三醇,并在-20℃下 (只要该蛋白可以冷冻) 存放。但是,还要注意样品自身是否稳定。 |
| Q9:能不能用这个试剂盒标记寡核苷酸和寡肽? |
| A:不能,寡核苷酸和寡肽的分子量太小不能使其保留在过滤膜上。请参照Q4。 |
| Q10:含有生物素标记蛋白质的活细胞怎么处理? |
| A:我们推荐使用PBS (含2-10% FBS) 制备细胞悬液,保持最佳细胞状态。 |
| Q11:回收缓冲液 (WS Buffer)对活细胞有危害吗? |
| A:没有。WS Buffer含有表面活性剂,它的浓度控制在对细胞没有毒性的范围内。如果您担心WS Buffer中的添加剂,请您使用常用的缓冲液代替。 |
参考文献
1) Y. Kubota, Y. Oike, S. Satoh, Y. Tabata, Y. Niikura, T. Morisada, M. Akao, T. Urano, Y. Ito, T. Miyamoto, N. Nagai, G. Y. Koh, S. Watanabe and T. Suda, “Cooperative Interaction of Angiopoietin-like Proteins 1 and 2 in Zebrafish Vascular Development “, Proc. Natl. Acad. Sci. USA, 2005, 102(38), 13502.
2) T. Yamabuki, A. Takano, S. Hayama, N. Ishikawa, T. Kato, M. Miyamoto, T. Ito, H. Ito, Y. Miyagi, H. Nakayama, M. Fujita, M. Hosokawa, E. Tsuchiya, N. Kohno, S. Kondo, Y. Nakamura and Y. Daigo, “Dikkopf-1 as a Novel Serologic and Prognostic Biomarker for Lung and Esophageal Carcinomas”, Cancer Res., 2007, 67, 2517.
3) H. Kohara, Y. Omatsu, T. Suhiyama, M. Noda, N. Fujii and T. Nagasawa, “Development of Plasmacytoid Dendritic Cells in Bone Marrow Stromal Cell niches Requires CXCL12-CXCR4 Chemokine Signaling”, Blood, 2007, 110(13), 4153.
4) N. Ishikawa, A. Takano, W. Yasui, K. Inai, H. Nishimura, H. Ito, Y. Miyagi, H. Nakayama, M. Fujita, M. Hosokawa, E. Tsuchiya, N. Kohno, Y. Nakamura and Y. Daigo, “Cancer-testis Antigen Lymphocyte Antigen 6 Complex Locus K is a Serologic Biomarker and a Therapeutic Target for Lung and Esophageal Carcinomas”, Cancer Res., 2007, 67(24), 11601.
5) A. Fukuda, T. Goto, K.N. Kuroishi, K.K. Gunjigake, S. Kataoka, S. Kobayashi and K. Yamaguchi, “Hemokinin-1 competitively inhibits substance P-induced stimulation of osteoclast formation and function”, Neuropeptides., 2013, 47, (4), 251.
6) A. Ogawa , M. Sakatsume, X. Wang, Y. Sakamaki, Y. Tsubata, B. Alchi, T. Kuroda, H. Kawachi, I. Narita, F. Shimizu and F. Gejyo, “SM22alpha: the novel phenotype marker of injured glomerular epithelial cells in anti-glomerular basement membrane nephritis”, Nephron Exp. Nephrol.., 2007, 106, (3), e77.
7) D. Men, T.T. Zhang, L.W. Hou, J. Zhou, Z.P. Zhang, Y.Y. Shi, J.L. Zhang, Z.Q. Cui, J.Y. Deng, D.B. Wang and X.E. Zhang, “Self-Assembly of Ferritin Nanoparticles into an Enzyme Nanocomposite with Tunable Size for Ultrasensitive Immunoassay”, ACS Nano., 2015, 9, (11), 10852.
8) D. Sugahara, Y. Kobayashi, Y. Akimoto, H. Kawakami, “Mouse intestinal niche cells express a distinct α1,2-fucosylated glycan recognized by a lectin from Burkholderia cenocepacia”, Glycobiology., 2017, 27, (3), 246.
9) H. Sasaki-Iwaoka, M. Ohori, A. Imasato, K. Taguchi, K. Minoura, T. Saito, K. Kushima, E. Imamura, S. Kubo, S. Furukawa and T. Morokata, “Generation and characterization of a potent fully human monoclonal antibody against the interleukin-23 receptor”, Eur. J. Pharmacol.., 2018, 828, 89.
10) K. Kaneshiro, M. Watanabe, K. Terasawa, H. Uchimura, Y. Fukuyama, S. Iwamoto, T.A. Sato, K. Shimizu, G. Tsujimoto and K. Tanaka, “Rapid quantitative profiling of N-glycan by the glycan-labeling method using 3-aminoquinoline/α-cyano-4-hydroxycinnamic acid”, Anal. Chem.., 2012, 84, (16), 7146.
11) K.S. Tan, K. Kulkeaw, Y. Nakanishi, D. Sugiyama, “Expression of cytokine and extracellular matrix mRNAs in fetal hepatic stellate cells”, Genes Cells., 2017, 22, (9), 836.
12) M. Tahara, S. Ohno, K. Sakai, Y. Ito, H. Fukuhara, K. Komase, M.A. Brindley, P.A. Rota, R.K. Plemper, K. Maenaka and M. Takeda, “The receptor-binding site of the measles virus hemagglutinin protein itself constitutes a conserved neutralizing epitope”, J. Virol.., 2013, 87, (6), 3583.
13) M. Takahashi, Y. Ishida, D. Iwaki, K. Kanno, T. Suzuki, Y. Endo, Y. Homma and T. Fujita, “Essential role of Mannose-binding lectin-associated serine protease-1 in activation of the complement factor D”, J. Exp. Med.., 2010, 207, (1), 29.
14) N. Hosen, Y. Matsunaga, K. Hasegawa, H. Matsuno, Y. Nakamura, M. Makita, K. Watanabe, M. Yoshida, K. Satoh, S. Morimoto, F. Fujiki, H. Nakajima, J. Nakata, S. Nishida, A. Tsuboi, Y. Oka, M. Manabe, H. Ichihara, Y. Aoyama, A. Mugitani , T. Nakao, M. Hino, R. Uchibori, K. Ozawa, Y. Baba, S. Terakura, N. Wada, E. Morii, J. Nishimura, K. Takeda, Y. Oji, H. Sugiyama, J. Takagi and A. Kumanogoh, “The activated conformation of integrin β7 is a novel multiple myeloma-specific target for CAR T cell therapy”, Nat. Med.., 2017, 23, (12), 1436.
15) R. Nishino, A. Takano, H. Oshita, N. Ishikawa, H. Akiyama, H. Ito, H. Nakayama, Y. Miyagi, E. Tsuchiya, N. Kohno, Y. Nakamura and Y. Daigo, “Identification of Epstein-Barr virus–induced gene 3 as a novel serum and tissue biomarker and a therapeutic target for lung cancer”, Clin. Cancer Res.., 2011, 17, (19), 6272.
16) T. Hiono, A. Matsuda, T. Wagatsuma, M. Okamatsu, Y. Sakoda and A. Kuno, “Lectin microarray analyses reveal host cell-specific glycan profiles of the hemagglutinins of influenza A viruses”, Virology., 2019, 527, 132.
17) T. Oshima, S. Sato, J. Kato, Y. Ito, T. Watanabe, I. Tsuji, A. Hori, T. Kurokawa and T. Kokubo, “Nectin-2 is a potential target for antibody therapy of breast and ovarian cancers”, Mol. Cancer., 2013, 12, (60), .
18) T. Yoshida, N. Shiraki, H. Baba, M. Goto, S. Fujiwara, K. Kume and S. Kume, “Expression patterns of epiplakin1 in pancreas, pancreatic cancer and regenerating pancreas”, Genes Cells., 2008, 13, (7), 667.
19) X. Piao, T. Ozawa, H. Hamana, K. Shitaoka, A. Jin, H. Kishi and A. Muraguchi, “TRAIL-receptor 1 IgM antibodies strongly induce apoptosis in human cancer cells in vitro and in vivo”, Oncoimmunology., 2016, 5, (5), e1131380.
20) Y. Shimazaki, Y. Kohno, “Successive analysis of antigen trapping and enzymatic digestion on membrane-immobilized avidin”, Anal. Biochem.., 2012, 422, (1), 55.
关联产品
实验工具|稀释计算器|摩尔浓度计算器
