上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 Lipi-Blue
Lipi-Blue
Lipi-Blue
- 細胞染色用色素
- 細胞機能解析
脂肪滴染色蛍光色素
-
製品コードLD01 Lipi-Blue
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 10 nmol ※ | ¥19,900 | 345-09361 |
※ 35 mm dish: 10 ~ 50 枚分
- ご購入方法
- お問い合わせ
マニュアル
-
取扱説明書 日本語

-
Manual English

技術情報
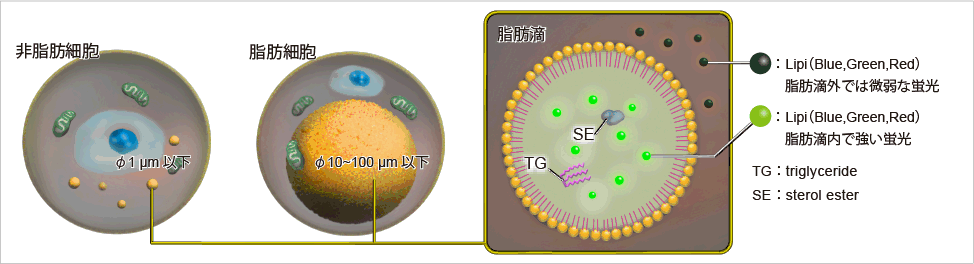
脂肪滴とその機能
脂肪滴は、トリアシルグリセロールやコレステロールエステルなどの中性脂肪が単分層のリン脂質一重膜によって取り囲まれた構造体です。脂肪滴は脂肪細胞のみに存在するわけではなく、すべての細胞に普遍的に存在しています。最近の研究から、脂肪滴はその表面に種々のタンパク質が結合し、体内の脂質代謝制御において重要な役割を担っていることが明らかになってきています1)。近年、脂肪滴とオートファジー2)、細胞老化3) といった細胞内現象との関連性も示唆されており、脂肪滴の形成・成長・融合・分解のメカニズムをより詳細に解明するツールが待ち望まれています。
1) T. Fujimoto et al., “Lipid droplets: a classic organelle with new outfits.” Histochem Cell Biol., 2008, 130(2), 263.
2) R. Singh et al., “Autophagy regulates lipid metabolism.” Nature, 2009, 458(7242), 1131.
3) M. Yokoyama et al., “Inhibition of endothelial p53 improves metabolic abnormalities related to dietary obesity.” Cell Reports, 2014, 7(5), 1691.
参考文献
1) Y. Tatenaka, H. Kato, M. Ishiyama, K. Sasamoto, M. Shiga, H. Nishitoh and Y. Ueno, "Monitoring Lipid Droplet Dynamics in Living Cells by Using Fluorescent Probes", Biochemistry., 2019, DOI: 10.1021/acs.biochem.8b01071 .
2) S. W. Kima, C. R. Rho, J. Kim, Y. Xie, R. C. Prince, K. Mustafa, E. O. Potma, D. J. Brown, J. V. Jester, "Eicosapentaenoic acid (EPA) activates PPARγ signaling leading to cell cycle exit, lipid accumulation, and autophagy in human meibomian gland epithelial cells (hMGEC)", The Ocular Surface, 2020, DOI: 10.1016/j.jtos.2020.04.012.
よくある質問
-
Q
オレイン酸溶液の調製方法と細胞への導入方法を教えてください。
-
A
小社では以下の手順でオレイン酸溶液を調製して使用しました。
<オレイン酸ストック溶液>
必要な試薬
・BSA (ウシ血清アルブミン)
・オレイン酸
・0.1 mol/L Tris-HCl (pH 8.0)調製手順 1) 0.1 mol/L Tris-HCl (pH 8.0)にBSAを添加し溶解する(BSA: 濃度 0.14 g/mL)。 2) 容器(ディスポーザブルの遠沈管など)にオレイン酸を入れた後、1)のBSA溶液を加えて回転振盪器を用いて混合する(オレイン酸濃度: 4 mmol/L)。*1 3) 2)の混合溶液を、ポアサイズが0.22 µmのシリンジフィルター(PTFE製)でろ過する。 4) 冷蔵保存して、都度、使用する。*2 *1オレイン酸とBSA溶液を混合すると液体中に曇りを生じる場合がありますが、振盪を続けるとオレイン酸 とBSAの複合体が形成され曇りが消失します。
*2実験で用いる培地にオレイン酸ストック溶液を必要量を添加して、細胞へのオレイン酸導入に使用してください。<細胞への導入方法> 1) 細胞を 5% CO2インキュベーター(37℃)内で、24時間培養する。 2) オレイン酸ストック溶液を添加した培地(オレイン酸の終濃度 200 μmol/L)に置換して、更に、24時間培養する。 3) その後、取扱説明書に従って、脂肪滴を蛍光染色して観察する。
-
Q
共染色時の推奨フィルターを教えてください。
-
A
ご使用の色素と励起波長に応じて、下記表を参照のうえ共染色に適したフィルターを選択ください。
励起波長
(共染色色素)405 nm
(Hoechst, DAPI etc.)488 nm
(FITC, GFP etc.)561 nm
(Cy3, Rhodamine, RFP etc.)633 nm
(Cy5, mCherry etc.)Lipi-Blue Lipi-Blueの蛍光観察 Lipi-Blueは488 nm, 561 nmおよび633 nmでは励起されません。
そのため何れの蛍光フィルターでもご使用いただけます。Lipi-Green Lipi-Greenは405 nmで若干励起されます。
Lipi-Greenの蛍光漏れ込みを抑えるため、400-500 nmの範囲内の蛍光フィルターをお勧めします。Lipi-Greenの蛍光観察 Lipi-Greenは561 nmおよび633 nmでは励起されません。
そのため、何れの蛍光フィルターでもご使用いただけます。Lipi-Red Lipi-Redは405 nmで若干励起されます。
Lipi-Redの蛍光漏れ込みを抑えるため、400-500 nmの範囲内の蛍光フィルターをお勧めします。Lipi-Redは488 nmで若干励起されます。
Lipi-Redの蛍光漏れ込みを抑えるため、500-550 nmの範囲内の蛍光フィルターをお勧めします。Lipi-Redの蛍光観察 Lipi-Redは633 nmで若干励起されます。
Lipi-Redの蛍光漏れ込みを抑えるため、650-700 nmの範囲内の蛍光フィルターをお勧めします。Lipi-Deep Red Lipi-Deep Redは、405および488 nmでは励起されません。
そのため何れの蛍光フィルターでもご使用いただけます。Lipi-Deep Redは561 nmで若干励起されます。
Lipi-Deep Red由来の蛍光漏れ込みを抑えるため、560-610 nmの範囲内の蛍光フィルターをお勧めします。Lipi-Deep Redの蛍光観察
-
Q
蛍光が確認できない場合の対処法は?
-
A
蛍光が検出されない場合、幾つか要因が考えられます。
下記に示した項目を確認し、状況によっては最適化条件をご検討ください。①励起・蛍光波長が色素の蛍光特性と合致していない。
製品HPに掲載の色素の蛍光スペクトルとお使いのフィルターを確認し、励起・蛍光波長が
合致しているかご確認ください。②染色条件が最適ではない。
[試薬濃度]
– working solutionの濃度を下記の範囲で検討する。
Lipi-Blue, Lipi-Green:0.1-0.5 μmol/L
Lipi-Red:1-5 μmol/L※上記条件でも蛍光が検出されない場合、更に高濃度で染色する。
Lipi-Blue, Lipi-Green:1-2 μmol/L
Lipi-Red:10-20 μmol/L[インキュベーション時間]
– 通常は30分ですが、試薬添加後に1-2時間インキュベートする。③固定化の条件が適していない。
細胞によっては染色前後の固定化操作により、染色されない又は感度が弱くなる場合があります。
その際は、「Q:固定化細胞への染色は可能ですか?」をご参照ください。④脂肪滴が小さくて確認が困難。
細胞によっては脂肪滴が小さく、確認が困難な場合があります。
その際は、高倍率の顕微鏡での確認、又はオレイン酸処理した細胞によるポジティブコントロールを
評価されることをお勧めします。
-
Q
固定化細胞への染色は可能ですか?
-
A
固定化した細胞でも染色は可能です。固定化細胞の染色手順は、下記を参照ください。
※固定化処理にはパラホルムアルデヒド(PFA)をご使用ください。メタノール等のアルコール固定は、脂肪滴の構造に影響を及ぼす可能性があるため、お勧めしません。
※細胞によっては、染色前後の固定化操作により、染色されない又は感度が弱くなる場合があります。その際は、固定化条件を検討頂く必要があります。○染色後に細胞を固定化した例 <実績細胞 : HepG2細胞>
①培地を除去し、PBSで二回洗浄した。
②プロトコル記載のWorking solution(in PBS)を細胞に入れ、37℃で15分インキュベートした。
③上清を除去し、PBSで二回洗浄した。
④4% PFA (in PBS)で5分間室温でインキュベートした。
⑤上清を除去し、PBSで洗浄後、観察。○染色前に細胞を固定化した例 <実績細胞 : HeLa細胞>
①培地を除去し、PBSで二回洗浄した。
②4% PFA (in PBS)で5分間室温でインキュベートした。
③上清を除去し、PBSで二回洗浄した。
④プロトコル記載のWorking solution(in PBS)を細胞に入れ、37℃で30分インキュベートした。
⑤上清を除去し、PBSで洗浄後、観察。


取扱条件
| 性状: | |
|---|---|
| 純度(HPLC): | 85.0% 以上 |

関連製品
この製品に関連する研究では、下記の関連製品も使われています。
-

脂肪滴測定キット
Lipid Droplet Assay Kit – Blue
-
過酸化脂質検出蛍光試薬
Liperfluo
-

オートファジー(オートリソソーム)の検出試薬
DALGreen – Autophagy Detection
-
老化細胞検出キット
Cellular Senescence Detection Kit – SPiDER-βGal
-
乳酸測定キット
Lactate Assay Kit-WST